
【题目】水星大气中含有一种被称为硫化羰(化学式为COS)的物质。已知硫化羰与CO2的结构相似,但能在O2中完全燃烧,下列有关硫化羰的说法正确的是
A. OCS的电子式为![]()
B. OCS分子中三个原子位于同一直线上
C. OCS的沸点比CO2的低
D. OCS分子中含有1个σ键和1个π键
科目:高中化学 来源: 题型:
【题目】(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸;②稀硫酸;③浓硝酸;④稀硝酸,能随即发生剧烈反应的是(填序号,下同)____________,常温下缓慢反应(或微热后能发生剧烈反应)的是____________,常温下不反应,但加热后发生剧烈反应的是____________,加热也不发生反应的是____________。由此可以得到上述四种酸氧化性由强到弱的顺序是____________。
(2)先将铜与浓硫酸加热时反应产生的气体X持续通入如图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括____________。
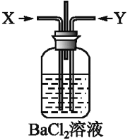
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是____________。
A.HNO3的酸性比H2SO4的强
B.盐酸的酸性比H2SO3的强
C.BaSO3能溶于盐酸
D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、硫、氯元素在科研与生产中也有许多重要的用途。请回答下列问题:
(1)磷原子在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式________ 。
(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为___________。但NCl5不存在,其原因是___________________。
(3)N、P两种元素都能形成多种气态氢化物。联氨(N2H4)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离方程式_______________________。
(4)①请推测①HC1O4、②H5IO6[可写成(HO)5IO]、③HIO4三种物质的酸性由强到弱的顺序为_________(填序号)。
②已知一定条件下发生反应:Na2O+NaCl=Na3OCl,该反应过程中破坏和形成的化学键有_________。
(5)复杂磷酸盐有直链多磷酸盐(如图b)和环状偏磷酸盐(如图c)。其酸根阴离子都是由磷氧四面体(图a)通过共用氧原子连接而成。直链多磷酸盐的酸根离子(图b)中,磷原子和氧原子的原子个数比为n:____;含3个磷原子的环状偏磷酸盐的酸根离子(图c)的化学式为_____。

(6)多原子分子中各原子若在同一平面,且有互相平行的p轨道,则p电子可在多个原子间运动,形成离域π键。分子中的π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π,则SO2中的大π键应表示为___________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π,则SO2中的大π键应表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物D对花香和果香的香味具有提升作用,故常用于化妆品工业和食品工业。有机物D可以用下面的设计方案合成。

(1)A的结构简式______,C的名称____,该流程中涉及到的共同的反应类型有____,D中的官能团的名称为_____。
(2)写出下列反应的化学方程式:
②__________________
③_________________
(3)芳香族化合物E的分子式与C相同,写出E可能结构的结构简式(可不填满):___、___、_____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
(2)通过K值的计算,(1)中的反应是_________反应(填“吸热”或“放热”)。
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(g),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
时间/min | CO2 | H2O | CO | H2 |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是:_______________________。
②在3~4min之间,反应处于___________状态(填“平衡”或“非平衡”)。
③第6min时,平衡向_________方向移动,可能的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式____________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)==2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)== N2(g)+2H2O (g);△H= -534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_____________。
(5)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g) △H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝鞣剂在皮革工业有广泛应用。某学习小组以铝灰为原料制备铝鞣剂[ Al(OH)2Cl],设计如下化工流程(提示:铝灰的主要成分是Al、Al2O3、AlN、FeO等):
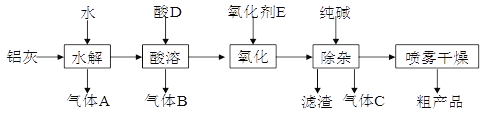
请回答下列问题:
(1)酸D的化学式为__________;气体C的电子式___________。
(2)实验室检验气体A的操作是________________;“水解”温度保持在90℃左右,写出水解生成A的化学方程式:________________________。
(3)“酸溶”温度控制在30℃~35℃,不宜太低,也不宜太高,其原因是_________________;氧化剂E宜选择_________(填字母)。
A.漂白液 | B.稀硝酸 | C.酸性高锰酸钾溶液 | D.溴水 |
(4)“除杂”过程中产生滤渣的离子方程式为_________________________。
(5)粗产品略显浅黄色,可能含有的杂质主要是_________________(填化学式)。
若用“蒸发”代替“喷雾干燥”,其后果是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是

A. OA段发生反应的离子方程式为:H++OH-===H2O CO32-+H+===HCO3-
B. 当加入35mL盐酸时,产生CO2的体积为224mL
C. A点溶液中的溶质为NaC1、NaHCO3
D. 混合物中NaOH的质量0.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g) ![]() 3Z(g)△H=-akJmol﹣1(a>0)。下列说法不正确的是
3Z(g)△H=-akJmol﹣1(a>0)。下列说法不正确的是
A.升高反应温度,逆反应速率增大,正反应速率减小
B.达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C.1molX和2molY完全反应生成3mol的Z,放出akJ的热量
D.0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com