
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
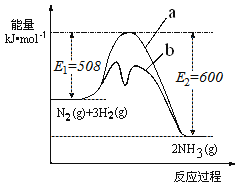
(1)根据如图提供的信息,写出该反应的热化学方程式____________________________,下图的曲线中________(填“a” 或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是_____________。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n molN2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)500℃、50MPa时,在容积为1 L的容器中加入1 mol N2、3 mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K=_______________。
(4)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 |
| 1 |
ⅱ | ______ |
| 10 |
ⅲ | 480 | ______ | 10 |
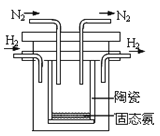
(5)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式为________________________。
【答案】N2(g) + 3H2(g)![]() 2NH3(g);ΔH=-92 kJ·mol-1 b B D
2NH3(g);ΔH=-92 kJ·mol-1 b B D ![]() 450
450 ![]() N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
【解析】
(1)由图1可知,1molN2(g)与3molH2(g)完全反应生成2molNH3(g)的反应热为508kJ/mol-600kJ/mol=-92kJ/mol,所以合成氨的热化学反应方程式为N2(g)+3H2(g)2NH3(g)△H═-92kJ/mol,催化剂能降低反应的活化能,b活化能较低;
(2)A.3υ(H2)正=2υ(NH3)逆说明:v (NH3)逆:v (H2)正═3:2不等于对应化学计量数之比,即正反应速率不等于逆反应速率,选项A错误;
B.单位时间内生成n mol N2的同时生成2n molNH3说明正反应速率等于逆反应速率,选项B正确;
C.体积不变,气体的质量不变,密度也会不变,用密度不变无法区分非平衡状态和平衡状态,选项C错误;
D.反应N2(g)+3H2(g)2NH3(g)是反应前后气体的总物质的量不相等的反应,当体积固定时,根据阿伏伽德罗定律可知,温度、体积相同时,气体的物质的量之比等于压强之比,容器内气压不随时间变化,说明气体的总物质的量不再发生变化,即说明可逆反应达到了化学平衡状态,选项D正确。
答案选BD;
(3)根据题意: N2(g)+3H2(g)2NH3(g),
初始物质的量浓度mol/L: 1 3 0
变化物质的量浓度mol/L: a 3a 2a
平衡物质的量浓度mol/L: 1-a 3-3a 2a
则平衡常数为K=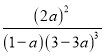 =
=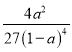 ;
;
(4)该实验为了寻找合成NH3的适宜条件,ⅱ应只改变压强,ⅲ应只改变温度,所以应填入的数据为:450;![]() ;
;
(5)电解池的阴极发生得电子的还原反应,在合成氨反应中,氮气得电子,所以阴极电极反应为N2+6H+ +6e-=2NH3。


科目:高中化学 来源: 题型:
【题目】如图是第三周期主族元素(11~17号)某些性质变化趋势的柱形图,下列有关说法中正确的是( )
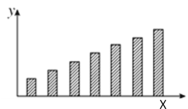
A. 若X轴为原子序数,y轴表示的可能是第一电离能
B. 若X轴为原子序数,y轴表示的可能是原子半径
C. 若X轴为最高正化合价,y轴表示的可能是电负性
D. 若X轴为族序数,y轴表示的可能是0.1mol/L最高价氧化物对应水化物溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)![]() 2HI(g);△H=-9.48 kJ·mol-1
2HI(g);△H=-9.48 kJ·mol-1
(ii)I2(S)+ H2(g)![]() 2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.反应(i)的产物比反应(ii)的产物稳定
C.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_____________________。
(2)通过K值的计算,(1)中的反应是_________反应(填“吸热”或“放热”)。
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2O(g),在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
时间/min | CO2 | H2O | CO | H2 |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是:_______________________。
②在3~4min之间,反应处于___________状态(填“平衡”或“非平衡”)。
③第6min时,平衡向_________方向移动,可能的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝鞣剂在皮革工业有广泛应用。某学习小组以铝灰为原料制备铝鞣剂[ Al(OH)2Cl],设计如下化工流程(提示:铝灰的主要成分是Al、Al2O3、AlN、FeO等):
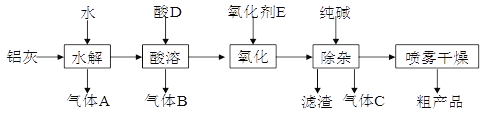
请回答下列问题:
(1)酸D的化学式为__________;气体C的电子式___________。
(2)实验室检验气体A的操作是________________;“水解”温度保持在90℃左右,写出水解生成A的化学方程式:________________________。
(3)“酸溶”温度控制在30℃~35℃,不宜太低,也不宜太高,其原因是_________________;氧化剂E宜选择_________(填字母)。
A.漂白液 | B.稀硝酸 | C.酸性高锰酸钾溶液 | D.溴水 |
(4)“除杂”过程中产生滤渣的离子方程式为_________________________。
(5)粗产品略显浅黄色,可能含有的杂质主要是_________________(填化学式)。
若用“蒸发”代替“喷雾干燥”,其后果是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)①铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是___ (填字母)。
A. 电子从基态跃迁到较高的激发态 B. 电子从较高的激发态跃迁到基态
C. 焰色反应的光谱属于吸收光谱 D. 焰色反应的光谱属于发射光谱
②碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
(2)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
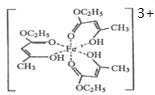
①此配合物中,基态铁离子的价电子排布图为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A.σ键 B.π键 C.极性键 D.非极性键 E. 配位键 F. 氢键 G.离子键
(3)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_____________。
(4)治疗铅中毒可滴注依地酸(别名EDTA,结构如下面左图)钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_________(填标号)
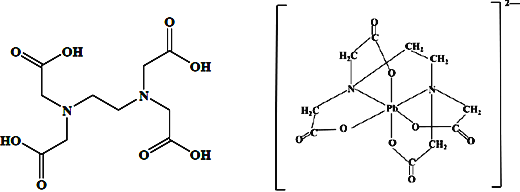
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
(5)AlCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态还是气态,一个分子中的氯原子与另外一个铝原子形成配位键,因此以二聚体Al2Cl6的形式存在,写出Al2Cl6的结构式_______(用→标出配位键)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN度液为主要原料制备黄血盐的流程如下:
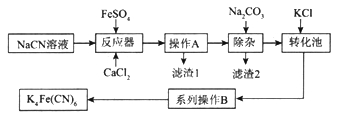
请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是__________________________。
②浓度均为0.5mol/L的NaCN和HCN的混合溶液显______(填“酸”“碱”或“中”)性,通过计算说明:_________________________。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:__________。
(3)系列操作B为_____________________。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。
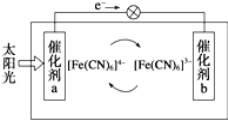
①K+移向催化剂___________(填“a”或“b”)。
②催化剂a表面发生的反应为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
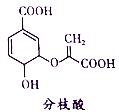
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com