
����Ŀ��ú�۸���������ǿ�ȣ�����Ҫ�õ���̿�⣬���ܵõ��±����е����ʣ�
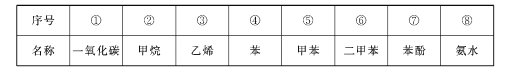
�ش��������⣺
(1)��Ȼ������Ҫ�ɷ���____������ţ���
(2)�μ��Ȼ�����Һ�ܱ�Ϊ��ɫ����____������ţ���
(3)������������������ԭ�ϻ��������____������ţ���
(4)�ܷ����Ӿ۷�Ӧ�����������������ʳƷ��װ������____������ţ���
(5)�ױ���һ��ȡ��������___�֣�
(6)���ױ�������ͬ���칹���У��е���͵���_____����ṹ��ʽ����
���𰸡� �� �� �� �� 4 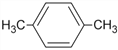
����������1����Ȼ������Ҫ�ɷ��Ǽ��飻
��2����ʹ�Ȼ�����Һ��Ϊ��ɫ���Ƿ������ʣ�
��3���������ӳɷ�Ӧ���ɻ����飻
��4���ܷ����Ӿ۷�Ӧ˵�����л����к���˫������������ֻ����ϩ���Ͻṹ�ص㣻
��5���ױ������ֲ�ͬ�����µ���ԭ�ӣ�
��6�����ױ�������ͬ���칹���У��е���͵��ǶԶ��ױ���
��1����Ȼ������Ҫ�ɷ��Ǽ��飬��Ϊ���ڣ�
��2����ʹ�Ȼ�����Һ��Ϊ��ɫ���Ƿ������ʣ����DZ��ӣ���Ϊ���ߣ�
��3���������ӳɷ�Ӧ���ɻ����飬��˿�����������������ԭ�ϻ�������DZ�����Ϊ���ܣ�
��4���ܷ����Ӿ۷�Ӧ˵�����л����к���˫������������ֻ����ϩ���Ͻṹ�ص㣬��ϩ�ۺ����ɾ���ϩ���ϣ�������ʳƷ��װ����Ϊ���ۣ�
��5���ױ������ֲ�ͬ�����µ���ԭ�ӣ�����1�֣�������3�֣���˼ױ���һ��ȡ��������4�֣�
��6�����ױ�������ͬ���칹���У��е���͵��ǶԶ��ױ����ṹ��ʽΪ![]() ��
��


 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д� ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮƽ�IJ�����ߺͻ���������ʶ�IJ�����ǿ����ͥ�̻������ռ�������ɫ��Ҷֲ���ʵ�����þԪ�أ���ʹ��������������ԭ����(����)
A. þ�Ǻϳɵ����ʵ�ԭ��
B. þ�Ǻϳɺ����ԭ��
C. þ�ܹ��ٽ�ֲ���ˮ�ֵ�����
D. þ�����Ҷ���ص���ҪԪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. Ca��ClO��2��Һ��ͨ������SO2��Ca2++2ClO-+SO2+H2O=CaSO4��+H++Cl-+ HClO
B. ��FeCl2��Һ��������NaClO��Һ��6Fe2++3ClO-+3H2O=2Fe��OH��3��+4Fe3++3Cl-
C. NH4HCO3��Һ������NaOH��Һ��ϣ�HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. ��Fe��NO3��3��Һ�м���������HI��Һ��2Fe3++2I-= 2Fe2++I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���3�������Ϊ1.0 L�ĺ����ܱ������з�Ӧ2H2(g)+CO(g)![]() CH3OH(g) �ﵽƽ�⡣����˵����ȷ����
CH3OH(g) �ﵽƽ�⡣����˵����ȷ����
���� | �¶�/K | ���ʵ���ʼŨ�ȣ�mol/L�� | ���ʵ�ƽ��Ũ�ȣ�mol/L�� | ||
c(H+) | c(CO) | c(CH3OH) | c(CH3OH) | ||
�� | 400 | 0.20 | 0.10 | 0 | 0.080 |
�� | 400 | 0.40 | 0.20 | 0 | |
�� | 500 | 0 | 0 | 0.10 | 0.025 |
A. �÷�Ӧ���淴Ӧ����
B. �ﵽƽ��ʱ���������з�Ӧ��ת���ʱ��������еĴ�
C. �ﵽƽ��ʱ����������c(H2)������������c(H2)������
D. �ﵽƽ��ʱ���������е�����Ӧ���ʱ��������еĴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ�������ͨ�����ʵ���Ũ�Ⱦ�0.1mol��L-1��CH4��CO2����һ�������·�����Ӧ��CO2��g��+CH4��g��![]() 2CO��g��+2H2��g�������CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ5�������й�˵����ȷ���ǣ� ��
2CO��g��+2H2��g�������CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ5�������й�˵����ȷ���ǣ� ��

A. ������Ӧ����H>0 B. ѹǿP1>P2>P3>P4
C. 1100���÷�Ӧ��ƽ�ⳣ��Ϊ64 D. ѹǿΪP4ʱ����Y�㣺v������<v���棩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ������ڵ�һ����
�� | ||||||||
�� | �� | �� | ||||||
�� | �� | �� | �� | |||||
(1)�١���Ԫ���н�������ǿ��Ԫ����___________(��Ԫ�ط��ű�ʾ)��
(2)������γɵĻ�����ĵ���ʽΪ____________��
(3)����Ԫ�آڡ��ۡ�����ۺ������������ǿ������˳����___________(�ѧʽ)��
(4)��116��Ԫ��(Ԫ�ط���Lv)���й���ѧ����������ίԱ������Ϊ��![]() ������Ԫ����Ԫ�����ڱ��е�λ����_____________��
������Ԫ����Ԫ�����ڱ��е�λ����_____________��
(5)����������ΪN��R2+��������ΪA����ng������ͬ��̬�������������ĵ��ӵ����ʵ���ԼΪ________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ����������
A. ��ɫ������Һ�У�Fe3+��Mg2+��SCN�C��Cl�C
B.  =1��1012����Һ�У�K+��Na +��CO32����NO3��
=1��1012����Һ�У�K+��Na +��CO32����NO3��
C. c(Fe2+) =1mol��L1����Һ�У�K+��NH4����MnO4����SO42��
D. ��ʹ���ȱ�����Һ�У�Na+��NH4����SO42����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. NH4+��Al3+��Cl-��HCO3-����Һ���ܴ�������
B. H2O2�ĵ���ʽ�ǣ�![]()
C. AlCl3��Һ�м�������İ�ˮ��Al3����3NH3��H2O��Al(OH)3����3NH4+
D. �����ǻ��������Fe2O3��nH2O��2<n<3����ʾ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ã�����ҺA��μ������B�У�����������ȷ����

A. ��AΪŨ���ᣬBΪMnO2��C��ʢƷ����Һ����C����Һ��ɫ
B. ��AΪ���ᣬBΪ���ǣ�C��ʢ��������ʯ��ˮ����C����Һ�����
C. ��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢAlCl3��Һ����C���Ȳ�����ɫ������������ܽ�
D. ��AΪŨ���ᣬBΪNa2SO3���壬C��ʢʯ����Һ����C����Һ�ȱ�����ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com