
【题目】(化学——选修3:物质结构与性质)
氮元素的单质及其化合物在科研、生产领域有着十分广泛的用途。回答下列问题:
(1)GaN是研制微电子器件、光电子器件的新型半导体材料,基态氮原子的核外具有__________种不同能量的电子;基态镓原子的核外电子排布式为__________。
(2)在硫酸铜溶液中加入过量氨水,得到深蓝色透明溶液,该溶液中存在![]() ,其中提供孤电子对的原子是__________,该配离子的结构可表示为__________。
,其中提供孤电子对的原子是__________,该配离子的结构可表示为__________。
(3)![]() 是一种重要的化工原料,可以制硝酸、化肥、硝酸盐,液态时可以做制冷剂。
是一种重要的化工原料,可以制硝酸、化肥、硝酸盐,液态时可以做制冷剂。![]() 分子中氮原子的杂化轨道类型为__________,氨气易液化的原因是____________________。
分子中氮原子的杂化轨道类型为__________,氨气易液化的原因是____________________。
(4)氮化硼是一种有着广泛用途的新型材料,主要结构有立方氮化硼和六方氮化硼两种。

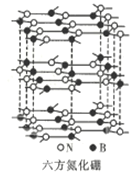
①立方氮化硼具有很高的硬度,仅次于金钢石,其晶体类型属于__________晶体,立方氮化硼中氮原子的配位数为__________。
②已知六方氮化硼同层中B与N原子核之间的距离为a cm,相邻层与层之间的距离为b cm,则该晶体的密度的计算式为__________![]() (用含a、b、
(用含a、b、![]() 的代数式表示)。
的代数式表示)。
【答案】3 [Ar]3d104s24p1 N 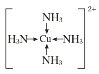 sp3 氨气分子间不只存在范德华力,还存在氢键,沸点比一般气体高,容易被液化 原子 4
sp3 氨气分子间不只存在范德华力,还存在氢键,沸点比一般气体高,容易被液化 原子 4 ![]()
【解析】
(1)相同能级上的电子具有相同的能量;根据构造原理书写基态镓原子的核外电子排布式;
(2)配合物中,配体提供孤电子对,中心原子提供空轨道形成配位键;
(3)![]() 分子中氮原子的价电子对数是
分子中氮原子的价电子对数是![]() ,氨气分子间存在氢键;
,氨气分子间存在氢键;
(4)①根据立方氮化硼硬度高分析晶体类型;根据立方氮化硼的晶胞图,离氮原子最近的B原子有4个;②根据![]() 计算;
计算;
(1)N原子核外电子排布在1s、s2、sp三个能级上,所以有3种不同能量的电子;镓原子核外电子数是31,核外电子排布式[Ar]3d104s24p1;
(2)![]() 中Cu2+是中心原子,提供空轨道,NH3是配体,N原子提供孤电子对;Cu2+通过4个配位键与4个NH3结合,该配离子的结构可表示为
中Cu2+是中心原子,提供空轨道,NH3是配体,N原子提供孤电子对;Cu2+通过4个配位键与4个NH3结合,该配离子的结构可表示为 ;
;
(3)![]() 分子中氮原子的价电子对数是
分子中氮原子的价电子对数是![]() ,氮原子的杂化轨道类型为sp3;氨气分子间不只存在范德华力,还存在氢键,沸点比一般气体高,容易被液化;
,氮原子的杂化轨道类型为sp3;氨气分子间不只存在范德华力,还存在氢键,沸点比一般气体高,容易被液化;
(4)①立方氮化硼硬度高,所以属于原子晶体;根据立方氮化硼的晶胞图,离氮原子最近的B原子有4个,氮原子的配位数为4;
②根据均摊原则,1个晶胞中B原子的数目是![]() 、N原子的数目是
、N原子的数目是![]() ;晶胞的体积是
;晶胞的体积是![]() ,根据
,根据![]() =
=![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列溶液中浓度关系正确的是( )
A. 小苏打溶液中:c(Na+)+c(H+)=c(HCO)+c(CO![]() )+c(OH-)
)+c(OH-)
B. CH3COONa溶液中:c(CH3COO-)>c(Na+)
C. 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D. 0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式中正确的是( )
A. 向氯化钙溶液中通入CO2:CaCl2+CO2+H2O=CaCO3↓+2HCl
B. 铁跟盐酸反应:Fe+2HCl=FeCl2+H2↑
C. NaHCO3溶液的电离方程式:NaHCO3=Na++H+ +CO32-
D. 向沸水中滴加 FeCl3 溶液制备Fe(OH)3 胶体:FeCl3+3H2O=Fe(OH)3↓+3HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中![]() 能与
能与![]() 按
按![]() 结合形成多种粒子,六步反应的平衡常数依次用
结合形成多种粒子,六步反应的平衡常数依次用![]() 表示。25℃时,各粒子的物质的量分数
表示。25℃时,各粒子的物质的量分数![]() 与
与![]() 的关系如图所示。下列叙述正确的是( )
的关系如图所示。下列叙述正确的是( )
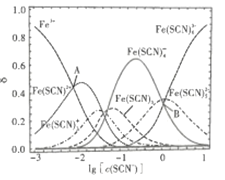
A. ![]() 依次增大
依次增大
B. 已知图中A点![]() 的值为-2.21,则
的值为-2.21,则![]()
C. ![]() 的
的![]()
D. 若图中B点![]() 的值为b、则
的值为b、则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1
C. 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L
D. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是

A. 由图Ⅰ知,该反应的△H>0 B. 由图Ⅱ知,该反应为放热反应
C. 由图Ⅲ知,t3时一定是采取降低反应温度的措施 D. 由图Ⅲ知,反应在t6时,NH3体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用氢氧化钠固体配制0.5mol·L-1的NaOH溶液490mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000 mL 容量瓶 ④500 mL 容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)计算需要的氢氧化钠的质量为_______;
(2)配制时,必须使用的仪器有_______(填代号),还缺少的仪器是______,该实验中玻璃棒有两种用途,请说出其中一种用途_______。
(3)下列配制的溶液浓度偏低的是_______;
a.配制前,容量瓶中有少量蒸馏水
b.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
c.加蒸馏水时不慎超过了刻度线
d.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)![]() Z(g)+W(s) △H>0,下列叙述正确的是
Z(g)+W(s) △H>0,下列叙述正确的是
A. 在容器中加入氩气,反应速率不变
B. 加入少量W,逆反应速率增大
C. 升高温度,正反应速率增大,逆反应速率减小
D. 将容器的体积压缩,可增大活化分子的百分数.有效碰撞次数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com