
【题目】分析下图所示的四个装置,其中结论正确的是( )
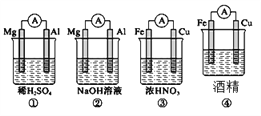
A. ①②中Mg作负极,③④)中Fe作负极
B. ②中Mg作正极,电极反应为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作负极,电极反应为Fe-2e-===Fe2+
D. ④中Fe作负极,电极反应为Fe-2e-===Fe2+
【答案】B
【解析】A、①中Mg、Al均能与H2SO4发生自发的氧化还原反应,Mg比Al活泼,Mg作负极;②中Al与NaOH发生自发的氧化还原反应,而Mg不反应,故负极为Al;③中Fe在浓硝酸中发生钝化,反应不能持续进行,Cu与浓硝酸能自发发生氧化还原反应,故Cu作负极;④中酒精为非电解质,不能构成原电池,A错误。B、②中Al与NaOH发生自发的氧化还原反应,而Mg不反应,故负极为Al,Mg作正极,水中的H+得到电子生成氢气,电极方程式为6H2O+6e-===6OH-+3H2↑,B正确。C、③中Fe在浓硝酸中发生钝化,反应不能持续进行,Cu与浓硝酸能自发发生氧化还原反应,故Cu作负极,Fe为正极,HNO3在正极上得电子生成NO2,电极方程式为:2H++NO3-+ e-=NO2↑+H2O,C错误。D、④中酒精为非电解质,不能构成原电池,D错误。正确答案为B。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料。以CO2为原料可合成多种物质。
(1)利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为:
①CH4(g) = C(s) + 2H2(g) △H = +75.0 kJ·mol1
②CO2(g) + H2(g) = CO(g) + H2O(g) △H = +41.0 kJ·mol1
③CO(g) + H2(g) = C(s) + H2O(g) △H = -131.0 kJ·mol1
反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H= ____。
(2)在一定温度下,向2L固定容积的密闭容器中通入2 mol CO2和6 mol H2发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。测得CO2和CH3OH(g)浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H<0。测得CO2和CH3OH(g)浓度随时间变化如下图所示。
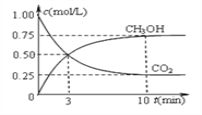
①前10 min内的平均反应速率υ(H2)=____ mol∕(L·min)。
②能说明该反应已达平衡状态的是____。
A.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1
B.混合气体的平均摩尔质量保持不变
C.CH3OH的体积分数在混合气体中保持不变
D.混合气体的密度不随时间变化
③下列措施能使n(CH3OH) ∕n(CO2) 增大的是____。
A.升高温度 B.恒温恒容充入He(g)
C.使用高效催化剂 D.恒温恒容下,再充入1mol CO2、3mol H2
④该温度下的平衡常数K=____(L∕mol)2。
(3)用100mL 0.25 mol∕L Na2CO3溶液吸收标准状况下336mL的CO2气体(溶液体积变化忽略不计),所得溶液中:c(HCO3)+c(CO32)+c(H2CO3)=____ mol∕L(填数字)。
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。

① b电极的名称是____。
② 请写出电解时生成乙烯的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 4.0 g H218O中所含电子数为2 NA
B. 0.1 mol H2O2分子中含极性共价键数目为0.3 NA
C. 将含0.1mol FeCl3的饱和溶液滴入沸水中,形成的胶体粒子的数目为0.1NA
D. 含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器发生可逆反应:4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O (g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
4NO(g) +6H2O (g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
A. 正逆反应速率相等且等于零
B. NH3、O2、NO和H2O浓度均相等
C. NH3、O2、NO和H2O在容器中共存
D. NH3、O2、NO和H2O浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及有机物的说法中正确的是
A.乙烯、氯乙烯都是不饱和烃,均可用于合成有机高分子材料
B.煤的干馏可得到煤焦油,煤焦油蒸馏可得到苯、甲苯等芳香烃
C.在加热条件下,加入适量生石灰以除去乙酸乙酯中含有的乙醇杂质
D.淀粉和纤维素的水解产物都是葡萄糖,二者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是( )
A.酸性高锰酸钾溶液、溴水
B.酸性高锰酸钾溶液、碳酸钠溶液
C.酸性高锰酸钾溶液、氢氧化钠溶液
D.酸性高锰酸钾溶液、氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素,无色,细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等症状,以致死亡。该外毒素为环状肽,其结构简式如图所示:

请据图分析回答:
(1)该化合物中含有游离的___________个氨基,___________个羧基。
(2)该化合物是由___________个氨基酸组成的,区别这些氨基酸的种类依靠的是其结构中的___________。
(3)组成该化合物的氨基酸有_________种,其中有_______个氨基酸的R基相同,这个R基是________。
(4)该化合物为___________肽化合物,含有___________个肽键。
(5)填写虚线框内结构的名称:A.______________________, B.______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在下列物质转化中A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外的同一种元素。请回答:
(1)A的化学式是______, Z的电子式是______。
(2)当X是强酸时,写出C→D的化学方程式:_____。
(3)当X是强碱时,写出E的稀溶液和铜反应生成C的离子方程式:_____。
II、在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (其相对分子质量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(4)为了洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是____(填字母代号)。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
(5)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
①上表中第一次实验中记录数据明显大于后两次,其原因可能是_____(填字母代号)。
A.滴定前滴定管尖嘴无气泡,滴定结束有气泡
B.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
D.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
②通过实验数据计算的该产品纯度为_____(用字母a、c表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com