
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ] | ① | ② | ||||
| 三 | ③ | ④ | ⑤ | ⑥ | |||
| 四 | ⑦ |
 .
. ,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+. 分析 由元素在周期表中的位置可知①②③④⑤⑥⑦分别为N、F、Na、Al、S、Cl、K等元素.
(1)②为F元素;
(2)同主族元素从上到下原子半径增大;
(3)⑤为S元素,对应的离子核外有18个电子;
(4)元素①的氢化物为氨气,为共价化合物,氨气通入氯化铝溶液中生成氢氧化铝沉淀.
解答 解:由元素在周期表中的位置可知①②③④⑤⑥⑦分别为N、F、Na、Al、S、Cl、K等元素.
(1)由以上分析可知②为F元素,故答案为:F;
(2)同主族元素从上到下原子半径增大,则原子半径③<⑦,故答案为:<;
(3)⑤为S元素,对应的离子核外有18个电子,离子结构示意图为 ,故答案为;
,故答案为; ;
;
(4)元素①的氢化物为氨气,为共价化合物,电子式为 ,氨气通入氯化铝溶液中生成氢氧化铝沉淀,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,氨气通入氯化铝溶液中生成氢氧化铝沉淀,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
故答案为: ;Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
;Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查位置、结构、性质的关系,为高频考点,把握元素的位置推断元素及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| B. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| C. | 25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,该溶液pH一定为14-a | |
| D. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
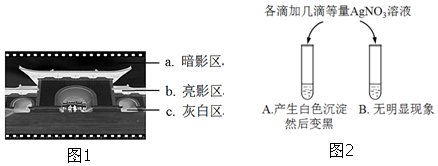
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电负性 | 第一电离能 | 熔点 | 沸点(同压) | 在水中溶解性 |
| C>H | S<P | NaF>KCl | PH3<NH3 | CH3OH>CH3SH |
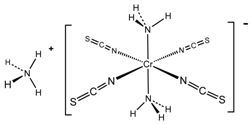
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2句 | B. | 3句 | C. | 4句 | D. | 5句 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “甘之如饴”说明糖类均有甜味 | |
| B. | “玉不琢不成器”“百炼方能成钢”发生的都是化学变化 | |
| C. | “火树银花”中的焰火实质上是金属元素的焰色反应 | |
| D. | “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2,3,3-三甲基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 2,3-二甲基-3-乙基丁烷 | D. | 2-乙基-2,3-二甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | Cu+2AgNO3═Cu(NO3)2+2Ag | D. | BaCl2+Na2SO4═BaSO4↓+2NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com