
| 电负性 | 第一电离能 | 熔点 | 沸点(同压) | 在水中溶解性 |
| C>H | S<P | NaF>KCl | PH3<NH3 | CH3OH>CH3SH |
分析 (1)电负性C>H;第一电离能对于同周期主族元素,第VA族大于VIA族;同为结构组成相似的离子晶体,晶格能越大,熔点越高;氢化物存在氢键,沸点异常升高;醇类物质在水中可以形成氢键,增加溶解度,据此判断;
(2)某半导体材料由X、Y两种元素组成,已知X的基态原子4p轨道上只有1个电子,可判断X的核外电子排布式为:[Ar]3d104s24p1,X为Ga,Y的基态原子L层上有3个未成对电子,则Y的核外电子排布式为:1s22s22p3,Y为N,据此解答;
(3)共价键成键的两个原子存在电负性差异就是极性共价键,分子中正负电荷中心重合,分子为非极性分子,据此分析判断;
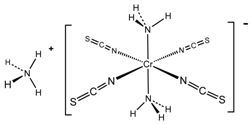
(4)根据结构式,配离子的中心离子为Cr3+,内界中与之成键的就是配体,形成的键为配位键,也是共价键的一种.
解答 解:(1)电负性C>H,
第一电离能对于同周期主族元素,第VA族大于VIA族,则第一电离能S<P,
NaF和KCl都是离子晶体,电荷数相同,但KCl的体积比NaF大,晶格能KCl比NaF小,晶格能越大,离子晶体熔点越高,则熔点NaF>KCl,
PH3和NH3均为分子晶体,但NH3分子间存在氢键,使NH3的沸点异常升高,则沸点PH3<NH3,
CH3OH在水中与H2O能形成分子间氢键,增大其溶解度,而CH3SH不能,则在水中溶解性CH3OH>CH3SH,
故答案为:>;<;>;<;>;
(2)某半导体材料由X、Y两种元素组成,已知X的基态原子4p轨道上只有1个电子,可判断X的核外电子排布式为:[Ar]3d104s24p1,X为Ga,Y的基态原子L层上有3个未成对电子,则Y的核外电子排布式为:1s22s22p3,Y为N,X是硼族元素,位于周期表中第四周期,第IIIA族,该半导体材料的化学式为GaN,
故答案为:四;IIIA;GaN;
(3)共价键成键的两个原子存在电负性差异就是极性共价键,分子中正负电荷中心重合,分子为非极性分子,
a.P4分子中P和P之间不存在电负性差异,是四面体构型,不含有极性共价键,分子中正负电荷中心从何,是非极性分子,不是由极性共价键构成的非极性分子,故a不选;
b.COS是羰基硫,与CO2是等电子体,二者结构相似,气态是直线型,存在极性共价键,但由于O和S的电负性存在差异,分子中正负电荷中心并不重合,是极性分子,故b不选;
c.CH3OCH3中C和H,C和O之间存在电负性差异,存在极性共价键,但分子中正负电荷中心不重合,是极性分子,故c不选;
d.BCl3分子中B和Cl存在电负性差异,B和Cl之间存在极性共价键,整个分子是平面三角形,分子中正负电荷中心重合,是非极性分子,故d可选;
故选d;
(4)配离子的中心离子为Cr3+,内界中与之成键的就是配体,根据结构式,配体有NH3和NCS-,
形成的键为配位键,
故答案为:NH3和NCS-;配位键.
点评 本题主要考查物质结构知识,涉及的知识点较多,有电负性,电离能,熔沸点,氢键,极性与非极性的判断,配合物的知识.题目难度不大,是基础题.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖 | B. | 乙酸 | C. | 蛋白质 | D. | 脂肪 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 将SO2通入紫色石蕊溶液中 | 证明SO2具有酸性和漂白性 |
| B | 用pH试纸测定NaHSO3溶液的pH | 比较HSO3-电离程度和水解程度的大小 |
| C | 溴乙烷与NaOH乙醇溶液共热,将得到的气体通入溴的四氯化碳溶液 | 证明反应得到的气体含有乙烯 |
| D | 向含酚酞的Na2SO3溶液中加入BaC12溶液 | 证明Na2SO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑥ | C. | ④⑤⑦ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.阴极的反应式是:H2O+2e-═H2↑+O2-,CO2+2e-═CO+O2-;阳极的反应式是:2H2O-4e-═O2↑+4H+.总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2.
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.阴极的反应式是:H2O+2e-═H2↑+O2-,CO2+2e-═CO+O2-;阳极的反应式是:2H2O-4e-═O2↑+4H+.总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH | B. | CH4 | C. | C3H8 | D. | C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ] | ① | ② | ||||
| 三 | ③ | ④ | ⑤ | ⑥ | |||
| 四 | ⑦ |
 .
. ,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤代烷水解时,从氟到碘,由于非金属性依次减弱,所以水解越来越困难 | |
| B. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| C. | 相同碳原子数的多卤代烃,随着卤原子数的增多,密度依次降低 | |
| D. | 常温下,CH3Cl是气体,甲烷的其他3种氯代产物都是液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 检验CO2与NaOH溶液反应后 的溶液中是否有Na2CO3 | 取少量反应后的溶液,滴加BaC12溶液,看是否有沉淀生成 |
| B | 除去甲烷中含有的乙烯杂质 | 将气体通入到酸性高锰酸钾溶液后,再通过装有碱石灰的干燥管 |
| C | 证明酸性:H2CO3>H3BO3 | 向Na2CO3中滴入过量H3BO3溶液,无气泡冒出 |
| D | 分离Fe(OH)3胶体和FeCl3溶液 | 将混合液倒入过滤器中过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com