
【题目】根据反应KMnO4+FeSO4+H2SO4-MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
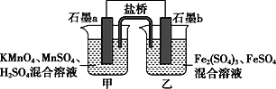
A.石墨b是原电池的负极,乙中发生氧化反应
B.电池工作时,盐桥中的K+向甲烧杯中移动
C.甲烧杯中的电极反应式:![]() +5e-+8H+=Mn2++4H2O
+5e-+8H+=Mn2++4H2O
D.忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
【答案】D
【解析】
根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极。电池工作时,SO42-向负极移动,甲烧杯中的石墨电极是正极,电极反应式为MnO4-+5e-+8H+═Mn2++4H2O,乙烧杯中的电极反应式为5Fe2+-5e-═5Fe3+,溶液中的Fe2(SO4)3浓度由1molL-1变为1.5molL-1,计算物质的量,结合化合价的变化可计算转移电子的物质的量据此回答。
A.据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极,b是原电池的负极,发生氧化反应,故A正确,不符合题意;
B.电池工作时,钾离子向正极(甲烧杯)移动,盐桥的作用是形成闭合回路,保持溶液中的电荷平衡,故B正确,不符合题意;
C.甲烧杯中的石墨电极是正极,发生还原反应,电极反应式为MnO4-+5e-+8H+═Mn2++4H2O,故C正确,不符合题意;
D.溶液中的Fe2(SO4)3浓度变为1.5mol/L,由于溶液的体积未变,则反应过程中生成的铁离子的物质的量为0.2mol,转移的电子为0.2mol,故D错误,符合题意。
答案选D。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
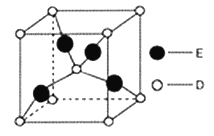
【题目】已知A、B、C、D、E是周期表中前四周期原子序数依次增大的五种元素。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同。D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。含E元素的硫酸盐溶液是制备波尔多液的原料之一。按要求回答下列问题:
(1)五种元素中第一电离能最大的是__________,电负性最大的是__________。(以上两空均填元素名称)
(2)基态E原子的价电子排布式为__________;E元素所在周期中基态原子的成单电子数最多的元素是__________(填元素符号)
(3)M分子中B原子的轨道杂化类型为__________,M分子中两种键角的大小关系是__________。(用∠XYZ表示,X、Y、Z代表元素符号)
(4)C3-的空间构型为__________;化合物CA3的沸点比BA4的高,其主要原因是__________。
(5)向E元素的硫酸盐溶液中通入过量的CA3,得到深蓝色的透明溶液,在此溶液中加入乙醇,析出深蓝色的晶体,此晶体中存在的化学键类型有__________。(填代号)
A.离子键 B.σ键 C.非极性共价健 D.配位键 E.金属键 F.氢键
(6)如图是D、E两种元素形成的化合物的晶胞结构示意图,D的配位数为__________。已知晶胞中最近两个D原子间距离为anm,阿伏伽德罗常数用NA表示,则该晶体的密度为__________g/cm3(用含a、NA的表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
![]()
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃。则操作1~4分别是( )
A. 萃取、过滤、蒸馏、蒸馏 B. 过滤、分液、蒸馏、萃取
C. 过滤、蒸馏、过滤、蒸馏 D. 过滤、分液、过滤、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是制备一种抗菌药的中间体,实验室以芳香化合物A为原料制备M的一种合成路线如下:
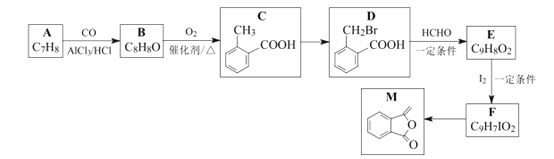
已知:R1CH2Br![]() R1CH=CHR2
R1CH=CHR2![]()
![]()
回答下列问题:
(1)B的化学名称为_________;E中官能团的名称为__________ 。
(2)C→D的反应类型为_______。
(3)写出D与氢氧化钠水溶液共热的化学方程式________________________。
(4)由F生成M所需的试剂和条件为_____________ 。
(5)X是D的同分异构体,同时符合下列条件的X可能的结构有______种(不含立体异构)。
①苯环上有两个取代基,含两个官能团; ②能发生银镜反应。
其中核磁共振氢谱显示4组峰的结构简式是___________(任写一种)。
(6)碳原子上连有4个不同的原子或原子团时,该碳称为手性碳。写出F的结构简式____________,用星号(*)标出F中的手性碳。
(7)参照上述合成路线和信息,以乙烯和乙醛为原料(无机试剂任选),设计制备![]() 的合成路线。______________________________。
的合成路线。______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应,生成NO的物质的量( )
A.0.02molB.0.03molC.0.04molD.0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应条件是研究化学反应的重要方向。
(1)化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g)+H2(g) △H=+139kJ·mol-1
C4H8(g)+H2(g) △H=+139kJ·mol-1
一定条件下,以异丁烷为原料生产异丁烯,在202kPa和808kPa下异丁烷平衡转化率随温度的变化如图所示。
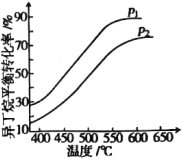
①p1=_______kPa,选择异丁烯制备的温度条件是550~600℃的理由是_________________。
②若平衡混合气中异丁烯的体积分数为25%,则异丁烷的平衡转化率为_______%(保留小数点后1位)。
(2)异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-0为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以r-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26. 17 | 27. 11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a 载体会影响催化剂的活性 b 载体会影响催化剂的选择性 c 载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:__________。
(3)工业上用复合氧化钴(组成为Co3O4)、碳酸锂以Li/Co(原子比)=1混合,在空气中900℃下加热5小时制备锂离子电池正极材料LiCo O2,写出制备LiCoO2的化学方程式__________。废旧的锂离子电池需要回收,“放电处理”废旧的锂离子电池有利于锂在正极回收的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1∶2∶3,则三种硫酸盐的物质的量浓度之比为( )
A. 1∶2∶3B. 1∶6∶9C. 1∶3∶3D. 1∶3∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光电池在光照条件下可产生电压,如下装置可以实现光能源的充分利用,双极性膜可将水解离为H+和OH-,并实现其定向通过。下列说法不正确的是
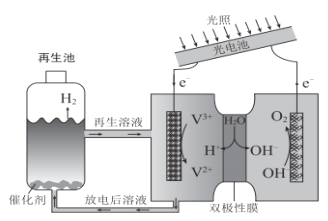
A.该装置将光能转化为化学能并分解水
B.双极性膜可控制其两侧溶液分别为酸性和碱性
C.如阳极区为KOH深液,在光照过程中阳极区溶液中的c(OH-)基本不变
D.再生池中的反应:2V2++2H+![]() 2V3++H2↑
2V3++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com