
| A.PCl3中P原子sp3杂化,为三角锥形 |
| B.BCl3中B原子sp2杂化,为平面三角形 |
| C.CS2中C原子sp杂化,为直线形 |
| D.H2S分子中,S为sp杂化,为直线形 |
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:阅读理解
(A)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。![]() 也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O![]() NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成
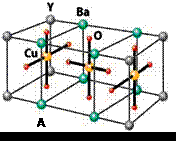
NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成![]() 。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:

(1)基态氮原子核外电子排布的轨道表示式为_____________。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为_____________。
(3)HN3属于_____________晶体,![]() 的空间构型是_____________,与
的空间构型是_____________,与![]() 互为等电子体的分子的化学式为_____________(写1种)。
互为等电子体的分子的化学式为_____________(写1种)。![]() 的电子式为____________,其中心原子的杂化类型是____________。
的电子式为____________,其中心原子的杂化类型是____________。
(4)![]() 中的键型为___________,超导氧化物A的化学式为___________。
中的键型为___________,超导氧化物A的化学式为___________。
(5)治癌药物B的结构简式为___________。
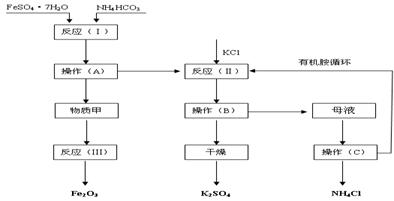
(B)以下是以绿矾、碳酸氢铵和氯化钾为原料制备生产市场较紧俏的硫酸钾产品的新工艺。已知:反应(Ⅰ)的化学方程式为:FeSO4·7H2O+2NH4HCO3![]() FeCO3↓+(NH4)2SO4+CO2↑+H2O
FeCO3↓+(NH4)2SO4+CO2↑+H2O
反应(Ⅱ)的化学方程式为:(NH4)2SO4+2KCl![]() K2SO4+2NH4Cl
K2SO4+2NH4Cl
工艺流程如下:

试回答下列问题:
(1)该工艺中的副产品是____________。(填化学式)
(2)操作C的名称为____________。
(3)原料绿矾、碳酸氢铵的最佳投料比是____________(质量比)时,FeSO4的转化率大于95%。
(4)物质甲是____________(填化学式),反应(Ⅲ)是甲物质与适量空气煅烧,温度为700—
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(A)(10分)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3—也被称为类卤离子。用酸与
 叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼
金属,如溶解铜生成CuCl2—。铜和铂的化合物在超导和医药上有重要应用,
Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2
的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试
回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为 。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为 。
(3)HN3属于 晶体,N3—的空间构型是_____,与N3—互为等电子体的分子的化学式为 (写1种)。NH2—的电子式为 ,其中心原子的杂化类型是 。
(4)CuCl2—中的键型为 ,超导氧化物A的化学式为
(5)治癌药物B的结构简式为
(B)(10分)以下是以绿矾、碳酸氢铵和氯化钾为原料制备生产市场较紧俏的硫酸钾产品的新工艺 。已知:反应(Ⅰ)的化学方程式为:FeSO4??7H2O+2NH4HCO3= FeCO3↓+(NH4)2SO4+CO2↑+H2O
反应(Ⅱ)的化学方程式为:(NH4)2SO4+2KC1=K2SO4+ 2NH4Cl
工艺流程如下:
试回答下列问题:
(1)该工艺中的副产品是 。(填化学式)
(2)操作C的名称为 。
(3)原料绿矾、碳酸氢铵的最佳投料比是 (质量比)时,FeSO4的转化率大于95%。
(4)物质甲是 (填化学式),反应(Ⅲ)是甲物质与适量空气煅烧,温度为700~800℃,煅烧时间为1~1.5 h时可获得符合国标一级品要求的氧化铁红,其化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省咸阳市高考模拟考试(二)理综化学试卷(解析版) 题型:填空题
卤族元素的单质和化合物很多,请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 ????????? 区;氟原子的电子排布图为?????? 溴原子的价电子排布式为????? .
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是??????????
(3)已知高碘酸有两种形式,化学式分别为H5IO6 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??????????? HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为???????????? 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6??????????? HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为???????????? 。
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大。这是由于溶液中发生下列反应 I-+ I2 =I3-与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 ??? 式发生。
A.CsICl2=CsCl+ICl?????? B.CsICl2 =CsI +Cl2
(5)ClO2-的空间构型为?????? 型,中心氯原子的杂化轨道类型为???????? ,写出一个ClO2-的等电子体 ???????????? 。
(6)如图为碘晶体晶胞结构。有关说法中正确的是???? 。

A.碘分子的排列有2种不同的取向
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3 .NA为阿伏加德罗常数,相邻的两个Ca2+核间距为a cm,则CaF2的摩尔质量可以表示为?????? 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_______区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
| 氟 | 氯 | 溴 | 碘 | 铍 |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl??????? B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(7)已知CaF2晶体(见图)的密度为ρ g·cm-3,NA为阿伏加德罗常数,最近相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com