
【题目】按要求完成下空:
(1)已知热化学方程式:SO2(g)+1/2O2(g)SO3(g) ΔH=-98.32 kJ·mol-1,在容器中充入2 mol SO2和1 mol O2,充分反应,最终放出的热量______(填字母)。
a.=196.64 kJ b.=98.32 kJ c.<196.64 kJ d.>196.64 kJ
(2)FeS2焙烧产生的SO2可用于制硫酸。其中SO2的空间结构为________;H2SO4中阴离子中心原子杂化类型为__________杂化。

(3)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式____________________________________
②捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq) ΔH3
则a:ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。b:若反应Ⅰ、反应Ⅱ的平衡常数分别为K1、K2,则反应Ⅲ的平衡常数K3=__________(用K1、K2表示)。
(4)元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,CrO42和Cr2O72在溶液中可相互转化。
①离子方程式表示Na2CrO4溶液中的转化反应____________。
②溶液酸性增大,CrO42的平衡转化率______(填“增大“减小”或“不变”)
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH______0 (填“大于”“小于”或“等于”)。
【答案】c V形 sp3 N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1 2ΔH2-ΔH1 K22/K1 2CrO42-+2H+![]() Cr2O72-+H2O 增大 小于
Cr2O72-+H2O 增大 小于
【解析】
(1)假设2molSO2和1molO2全部参与反应,放出的热量为2×98.32kJ=196.64kJ,因为该反应为可逆反应,不能进行到底,因此达到平衡放出的热量小于196.64kJ,故c正确;
(2)SO2中心原子S有2个σ键,孤电子对数为(6-2×2)/2=1,价层电子对数为3,空间构型为V形;阴离子为SO42-,S有4个σ,无孤电子对,因此S的杂化类型为sp3;
(3)①根据图示,该反应为放热反应,热化学反应方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=2×(254-300)kJ·mol-1=-92kJ·mol-1;
2NH3(g) △H=2×(254-300)kJ·mol-1=-92kJ·mol-1;
②a:根据反应III的方程式,2×II-I:△H3=2△H2-△H1;
b:根据化学平衡常数的表达式,推出K1=c[(NH4)2CO3]/c(CO2),K2=c(NH4HCO3)/c(CO2),K3=c2(NH4HCO3)/{c(CO2)×c[(NH4)2CO3]},得出K3=K22/K1;
(4)①CrO42-在溶液中存在:2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
②根据①酸性增大,c(H+)增大,平衡向正反应方向进行,CrO42-的转化率增大;
③根据勒夏特列原理,升高温度,CrO42-的转化率降低,反应向逆反应方向进行,即正反应方向为放热反应,△H<0。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】现有H2与O2的混合气体共0.6mol,该混合气体相对H2的密度为11,则下列说法正确的是( )
A.该混合气体的平均摩尔质量为11g/mol
B.混合气体中H2的物质的量为0.3mol
C.混合气体中O2的质量为12.8g
D.混合气体中H2和 O2的体积之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂海水电池的反应原理为:2Li+2H2O=2LiOH+H2↑,其示意图如图所示。有关该电池工作时说法错误的是

A.金属锂作正极
B.镍电极上发生还原反应
C.海水作为电解质溶液
D.可将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法不正确的是( )


A.反应过程(1)的热化学方程式为A2(g)+B2(g)C(g)ΔH1=-Q1 kJ/mol
B.反应过程(2)的热化学方程式为C(g)A2(g)+B2(g)ΔH2=+Q2 kJ/mol
C.Q1与Q2的关系:Q1>Q2
D.ΔH2>ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是
A.  所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
B.  所示装置验证二氧化硫的漂白性
所示装置验证二氧化硫的漂白性
C.  所示装置分离四氯化碳和苯的混合物
所示装置分离四氯化碳和苯的混合物
D.  所示装置检验氯化铵受热分解生成的两种气体
所示装置检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(主要为NO和NO2)是大气污染物,如何有效地消除氮氧化物污染是目前科学家们研究的热点问题之一。
(1)用尿素[CO(NH2)2]吸收氮氧化物是一种可行的方法。
①尿素在高温条件下与NO2反应转化成无毒气体,该反应的化学方程式为___________;用尿素溶液也可吸收氮氧化物,研究表明,氮氧化物气体中NO的体积分数越大,总氮被还原率越低,可能的原因是______。
②在一个体积固定的真空密闭容器中充入等物质的量的CO2和NH3,在恒定温度下使其发生反应2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示:
CO(NH2)2(s)+H2O(g)并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示:

则A点的v正(CO2)___________(填“>”“<”或“=”)B点的v逆(H2O),原因是________________。
(2)已知O3氧化氮氧化物的主要反应的热化学方程式如下:2NO(g)+O2(g)=2NO2(g)△H1=akJ·mol-1,NO(g)+O3(g)=NO2(g)+O2(g)△H2=bkJ·mol-1,6NO2(g)+O3(g)===3N2 O5(g)△H3=c kJ·mol-1,则反应4NO2(g)+O2(g)=2N2O5(g)的△H=___________kJ·mol-1。
(3)氮氧化物也可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,则该盐的化学式为_______;已知常温下,Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq)![]() NaNO2(ag)+H2O(1)的平衡常数K=___________,相同物质的量浓度的HNO2、NaNO2混合溶液中,各离子的物质的量浓度由大到小的顺序为___________。
NaNO2(ag)+H2O(1)的平衡常数K=___________,相同物质的量浓度的HNO2、NaNO2混合溶液中,各离子的物质的量浓度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(C11H8O4)是一种酯类物质,在NaOH溶液中加热反应后再酸化可得到化合物B和C。回答下列问题:
(1)B的分子式为C2H4O2,分子中只有一个官能团,且与NaHCO3溶液反应有气体产生。则B的结构简式是_________,写出B与NaHCO3溶液反应的化学方程式________。写出两种能发生银镜反应的B的同分异构体的结构简式_________、________。
(2)C是芳香化合物(含有苯环的有机物),相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,则C的分子式是_________。(已知:相对原子质量:C—12;O—16:H—1)
(3)已知C的苯环上有三个取代基,其中一个取代基(设为—X)无支链,且含有能与溴的四氯化碳溶液按1:1完全反应的官能团以及含有能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的含有官能团名称是_________。另外两个取代基相同,则名称为_______;另外相同的两个取代基分别位于取代基(—X)的邻位和对位,则C的结构简式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于含氮微粒的表述正确的是
A. N3-最外层电子数为5 B. N3-质子数为21
C. N原子核外有7种能量不同的电子 D. N2的电子式是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)锌离子的电子排布式是_____________。
(2)根据元素周期律,电负性S______Se,第一电离能Se______As(填“>”或“<”)。
(3)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
(4)NaCl晶胞如图所示,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。晶胞中Na+的配位数为____,若晶胞参数为a pm,阿伏加德罗常数的值用NA表示,若晶体密度为_______g·cm﹣3。(列出表达式)。

(5)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于_______。若已知铜的原子半径为rcm,表示原子空间占有率的表达式为__________。
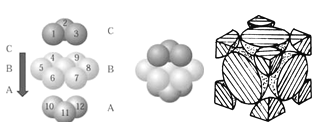
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com