
【题目】某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图步骤进行提纯。下列说法不正确的是
![]()
A. 起始滤液常温下pH﹥7 B. 试剂Ⅰ可选用BaCl2溶液
C. 步骤③目的是除去CO32- D. 上述提纯过程包括过滤、蒸发、分液等操作
【答案】D
【解析】
除去KCl样品中含有的少量K2CO3和K2SO4,首先加入过量BaCl2溶溶液(试剂Ⅰ)除去SO42-,再加入过量K2CO3溶液(试剂Ⅱ)除去Ba2+,最后加入适量HCl溶液(试剂Ⅲ)除去CO32-。据此分析。
除去KCl样品中含有的少量K2CO3和K2SO4,首先加入过量BaCl2溶溶液(试剂Ⅰ)除去SO42-,再加入过量K2CO3溶液(试剂Ⅱ)除去Ba2+,最后加入适量HCl溶液(试剂Ⅲ)除去CO32-。
A项,K2CO3显碱性,使得起始滤液常温下pH﹥7,故A项正确;
B项,由分析可知,试剂Ⅰ为BaCl2溶液,故B项正确;
C项,步骤③加入的是HCl溶液,目的是除去CO32-,故C项正确;
D项,上述提纯过程包括过滤、蒸发、没有分液操作,故D项错误。
故答案为D。


科目:高中化学 来源: 题型:
【题目】芳香烃A可用于合成利多卡因药物,盐酸利多卡因(F)葡萄糖注射液,可用于抗心律失常。其合成路线如下

已知: 。
。
(1)写出A的名称______________________。
(2)B在核磁共振氢谱上有_________种特征吸收峰。
(3)B→C的反应类型是_____________;D→E的反应类型是________________。
(4)B有多种同分异构体,符合以下条件的B的同分异构体共有_________种,请写出其中一种的结构简式_____________________。
①苯环上共有三个取代基 ②与碳酸钠溶液反应可放出CO2气体
(5)1molD与足量的NaOH水溶液共热反应,最多消耗NaOH的物质的量为______。
(6)对氨基苯甲酸是机体细胞生长和分裂所必需的叶酸的组成成分。现以甲苯为原料,结合题干有关信息,补充完成以下合成路线:______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g)是一放热反应。如果反应在密闭容器中进行,下列有关说法中不正确的是( )
2NH3(g)是一放热反应。如果反应在密闭容器中进行,下列有关说法中不正确的是( )
A. 升高温度会使反应速率加快
B. 当NH3的浓度不再变化时,反应达到了平衡状态
C. 在高温和催化剂作用下,H2可以100%地转化为NH3
D. 使用催化剂可以加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。已知在25℃、101kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是中学化学常见的单质,Y、Z为化合物。它们有如图所示的转化关系(部分产物及反应条件省略)。下列判断正确的是
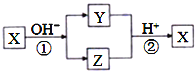
A. X可能是金属,也可能是非金属
B. X、Y、Z含有一种相同的元素
C. Y、Z的水溶液一定都呈碱性
D. 反应①②不一定都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】引起化学反应中能量变化的原因解释正确的是( )
A.化学反应前后物质的种类和数量发生变化
B.化学反应前后原子的种类和数目没有发生改变,但分子的种类改变
C.反应物化学键断裂吸收的总能量与生成物化学键形成时放出的总能量不同
D.反应物中1 mol键断裂吸收的能量与生成物形成1 mol键放出的能量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中a/b=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________。
(3)下列叙述中能说明上述反应达到平衡状态的是________(填字母)。
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
Ⅱ.某研究性学习小组为探究铁与稀盐酸反应,取同质量、体积的铁片、同浓度的盐酸做了下列平行实验:
实验①:把纯铁片投入到盛有稀盐酸的试管中,发现放出氢气的速率变化如图所示:

实验②:把铁片投入到含FeCl3的同浓度稀盐酸中,发现放出氢气的量减少。
实验③:在稀盐酸中滴入几滴CuCl2溶液,用铁片做实验,发现生成氢气的速率加快。
试回答下列问题:
(1)分析实验①中t1~t2速率变化的主要原因是_______,t2~t3速率变化的主要原因是______。
(2)实验②放出氢气的量减少的原因是___________________(用离子方程式表示)。
(3)某同学认为实验③反应速率加快的主要原因是形成了原电池,你认为是否正确?_____(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a.若不正确,请说明原因。
b.若正确,则写出实验③中原电池的正、负极电极反应式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 植物油的主要成分是高级脂肪酸
B. 异丙苯(![]() )中碳原子可能处于同一平面上
)中碳原子可能处于同一平面上
C. 某些蛋白质可溶于溶剂形成分子胶体,但遇乙醇发生变性
D. 分子式为C4H10O并能与金属钠反应的有机物有5种(不含立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com