
| 6.72L |
| 22.4L/mol |
| 0.1mol×108g/mol |
| 30g |
| 0.3mol×2+0.1mol×1 |
| 4 |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、若甲、乙两容器均为恒容容器,则x必等于2 |
| B、若甲、乙两容器均为恒压容器,则x必等于3 |
| C、若甲为恒容容器、乙为恒压容器,且 x=3,则 n1必大于n2 |
| D、若甲为恒压容器、乙为恒容容器,且 x≠3,则 n1必大于n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若开始通入3mol A和3mol B,达到平衡后将生成3a mol C | ||
| B、若开始通入3mol A、2mol B和1mol C,达到平衡后密闭容器中C的物质的量可能为3mol | ||
| C、若开始时通入2mol A、2mol B和1mol C,达到平衡时,B的物质的量一定小于2mol | ||
D、若开始时通入2molA、2mol B和1mol C,达到平衡后,再通入2 mol C,则再次到达平衡后,C的物质的量分数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验SO42-的试剂是HCl和BaCl2 |
| B、检验Cl-的试剂是AgNO3和HNO3 |
| C、向溶液中加入BaCl2后生成白色沉淀,即证明有SO42- |
| D、检验CO32-的试剂HCl,澄清的石灰水,和CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3OH和CH3CH2CH2OH |
| B、CH3CH2OH和CH3CH(OH)CH3 |
| C、CH3CH2OH和CH3(CH2)3CH2OH |
| D、CH3CH2CH2OH和CH3(CH2)3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
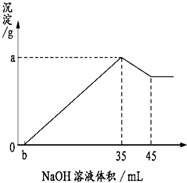 准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,
准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,| A、1.75 mol/L |
| B、3.5 mol/L |
| C、2.25 mol/L |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入一定量的CaCl2 |
| B、加入5 mL 1.5 mol?L-1盐酸 |
| C、加入15 mL 0.5 mol?L-1盐酸 |
| D、加入5 mL H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com