

| ||
| 2 |
| 2 |
| 2 |
| 2 |
| m |
| V |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| M |
| NA |
| ||
16
|
| M | ||
4
|
| M | ||
4
|


科目:高中化学 来源: 题型:
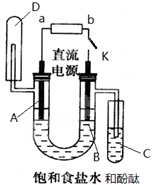 某实验兴趣小组利用如图装置进行电解饱和食盐水并检验其生成产物的实验,当图中开关K闭合片刻后,试填空:
某实验兴趣小组利用如图装置进行电解饱和食盐水并检验其生成产物的实验,当图中开关K闭合片刻后,试填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| B、将混有乙烯的乙烷气体通入酸性高锰酸钾溶液,可得到纯净的乙烷气体 |
| C、将苯与溴水混合后,再加铁粉,即可制得溴苯 |
| D、在蔗糖溶液中加入几滴稀硫酸,水浴加热5 min,加入NaOH溶液至碱性,再加入银氨溶液并水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4、C2H4 |
| B、CH4、C3H6 |
| C、C2H4、C3H8 |
| D、C2H2、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③④ | C、②③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、参加反应HNO3物质的量为0.9mol |
| B、参加反应的金属质量为11.9g |
| C、HNO3物质的量浓度为3mol/L |
| D、NaOH物质的量浓度为6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃煤时加入适量石灰石,可减少废气SO2的排放量 |
| B、空气中臭氧的含量越高,对人体健康越有利 |
| C、PH在5.6-7之间的降水通常称为酸雨 |
| D、含磷洗涤剂易于被细菌分解,故不会导致水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 |
| D、铁管上镶嵌锌块,铁管不易被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com