
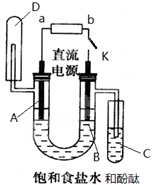
 某实验兴趣小组利用如图装置进行电解饱和食盐水并检验其生成产物的实验,当图中开关K闭合片刻后,试填空:
某实验兴趣小组利用如图装置进行电解饱和食盐水并检验其生成产物的实验,当图中开关K闭合片刻后,试填空:
| ||
| ||


科目:高中化学 来源: 题型:
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | II | 良 |
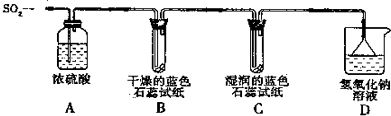
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若甲、乙两容器均为恒容容器,则x必等于2 |
| B、若甲、乙两容器均为恒压容器,则x必等于3 |
| C、若甲为恒容容器、乙为恒压容器,且 x=3,则 n1必大于n2 |
| D、若甲为恒压容器、乙为恒容容器,且 x≠3,则 n1必大于n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
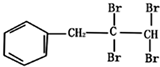 与NaOH的水溶液共热的化学方程式为
与NaOH的水溶液共热的化学方程式为
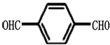 )的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为
)的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 | B、氯化钾溶液 |
| C、硝酸银溶液 | D、硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X和Y可能都是固体 |
| B、X和Y一定都是气体 |
| C、若Y为固体,X一定是气体 |
| D、X和Y不可能都是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com