
【题目】计算以下数值(均为25℃时)
(1)某浓度的NH3·H2O溶液中,由水电离的c(H+)=1×10-12mol/L,该溶液的 pH=
(2)将pH=3的H2SO4 溶液和pH=12的NaOH溶液混合, 混合后所得溶液的PH=10,则H2SO4 溶液与NaOH溶液的体积比为
(3)向0.02mol/L的MgCl2溶液中加入NaOH固体,若要生成Mg(OH)2沉淀,溶液的pH最低为(已知Ksp[Mg(OH)2]=3.2×10-11,lg2.5=0.4)
(4)①盐碱地因含较多的 ![]() ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4 , 微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4 , 微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
②SOCl2是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将SOCl2与FeCl36H2O混合并加热,可得到无水FeCl3 , 得到无水FeCl3的化学方程式为
【答案】
(1)12
(2)9:1
(3)9.6
(4)Na2CO3+CaSO4═Na2SO4+CaCO3;FeCl36H2O+6SOCl2=FeCl3+6SO2↑+12HCl↑
【解析】(1)某浓度的NH3H2O溶液中的氢离子是水电离的,也是溶液中氢离子浓度,即溶液中(H+)=1×10-12mol/L,则溶液的pH=12;
(2)pH=-lg(H+),pH=12的氢氧化钠溶液中(H+)=1×10-12mol/L,c(OH-)=0.01mol/L。pH=3的H2SO4 溶液中氢离子浓度,则c(OH-)=(0.01mol/L×V碱0.001mol/L×V酸)/(V酸+V碱) =0.0001mol/L,解得:V酸:V碱=9:1;
(3)Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=3.2×10-11 , 如果溶液中Qc>Ksp[Mg(OH)2]就能产生沉淀,c(OH-)= ![]() =4×10-5 mol/L,则(H+)=2.5×10-10mol/L,所以pH=9.6;
=4×10-5 mol/L,则(H+)=2.5×10-10mol/L,所以pH=9.6;
(4)①酸根离子水解显碱性,导致盐碱地产生碱性,水解离子反应为CO32-+H2O ![]() HCO3-+OH- , 石膏能与碳酸根离子反应,平衡向左移动,OH-浓度降低,降低碱性,石膏电离出的Ca2+与CO32-结合生成更难溶的CaCO3 ,反应方程式为:Na2CO3+CaSO4=Na2SO4+CaCO3;
HCO3-+OH- , 石膏能与碳酸根离子反应,平衡向左移动,OH-浓度降低,降低碱性,石膏电离出的Ca2+与CO32-结合生成更难溶的CaCO3 ,反应方程式为:Na2CO3+CaSO4=Na2SO4+CaCO3;
②使SOCl2与FeCl36H2O混合并加热,可得到无水FeCl3 , SOCl2与水反应生成的氯化氢会对氯化铝水解起到抑制作用,反应的化学方程式为:FeCl36H2O+6SOCl2=FeCl3+6SO2↑+12HCl↑。
所以答案是:(1)12;(2)9:1;(3)9.6;(4)①Na2CO3+CaSO4=Na2SO4+CaCO3;②FeCl36H2O+6SOCl2=FeCl3+6SO2↑+12HCl↑


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】J、L、M、R、T是原子序数依次增大的短周期元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
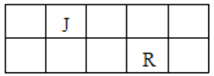
(1)M的离子结构示意图为_______________;元素T在周期表中位于第_________族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______________。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____________________。
(4)L的最简单气态氢化物甲的水溶液显碱性。
在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________________________________。
(5)由J、R形成的液态化合物JR2 0.2 mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215 kJ。该反应的热化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)及其化合物在生产、医疗、科技等方面有许多应用
(1)中国自古“信口雌黄”、“雄黄入药”之说。雄黄As2S3和雌黄As4S4都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。一定条件下,雌黄和雄黄的转化关系如图所示。
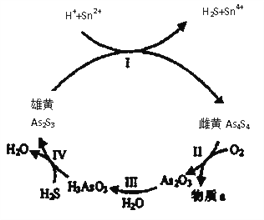
①雌黄和雄黄中S元素均为-2,I中发生的离子方程式是__________。
②Ⅱ中,雌黄在空气中加热至300℃时会产生两种物质,若4.28g As4S4反应转移0.28mole-,则a为__________(填化学式);砒霜(As2O3)可水将氧化成H3AsO4而除去,该反应的化学方程式为:__________。
(2)AsH3是一种很强的还原剂,室温下, 0.4mol AsH3气体在空气中自燃,氧化产物为As2O3固体,放出b kJ 热量,AsH3自燃的热化学方程式是:__________。
(3)将Na3AsO3(aq)+I2(aq)+H2O(l)![]() Na2HAsO4(aq)+NaI (aq)设计成原电池如图所示,放电时电流强度(I)与时间关系如图所示.
Na2HAsO4(aq)+NaI (aq)设计成原电池如图所示,放电时电流强度(I)与时间关系如图所示.
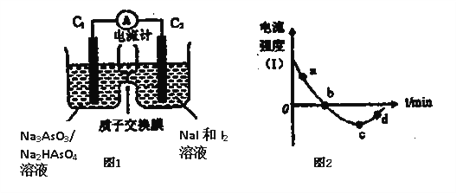
①如图中表示在该时刻上述可逆反应达到平衡状态的点是__________(填字母)。
②已知:a点对应如图中电流由C1极经外电路流向C2极。则d点对应的负极的反应式为__________。
③如图中,b→c改变条件可能是__________(填代号)。
A.向左室中加入适量的浓Na3AsO3溶液 B.向左室中加入适量的烧碱溶液
C.向右室中加入适量的浓KI溶液 D. 向右室中加入适量的稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. HF的稳定性很强,是因为HF分子之间能形成氢键
B. 水结成冰时,H—O键的键长变长,密度减小
C. 含氢元素的化合物中一定有氢键
D. 能与水分子形在氢键的物质易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的说法正确的是
A.有人设想通过特殊的方法将碳酸钙加工成为纳米碳酸钙,纳米碳酸钙是与胶体相似的分散系
B.氢氧化铁胶体、葡萄糖溶液用激光笔照射,均能观察到一条光亮的通道
C.明矾溶于水能形成胶体,可用于自来水的杀菌消毒
D.胶体的分散质粒子能通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图每一方框中的字母代表一种反应物或生成物: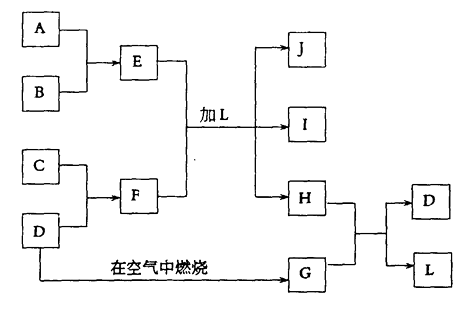
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为:
(2)用电子式表示F的形成过程
(3)写出E+F+L=J+I+H反应的离子方程式:
(4)H和G之间反应的化学方程式为: , 每生成2.4克的D转移 mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取含Cr2O72-的模拟水样若干份,在不同pH条件下,分别向每个水样中加一定量的FeSO4或NaHSO3固体,充分反应后再滴加碱液生成Cr(OH)3沉淀,从而测定除铬率,实验结果如图所示。下列说法正确的是
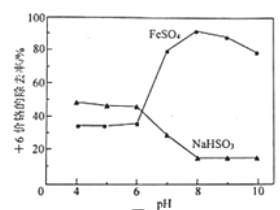
A. 理论上FeSO4的除铬率比等质量的NaHSO3高
B. 用NaHSO3除铬时,pH越低,越有利于提高除铬率
C. pH>8,FeSO4的除铬率下降与废水中溶解氧参与反应有关
D. 从提高除铬率的角度分析,处理酸性含铬废水应选用NaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)==2NO(g) △H =+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H =-221kJ·mol-1
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)],请写出此反应的热化学方程式_______。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
C(N2O6)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0,第3.00 min时体系压强为P1,则P1:P0=_______;2min~5.00min 内,O2 的 平 均反应速率为_____________。
②一定温度下,在恒容密闭容器中充人一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___。
a.NO2 和O2 的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)= v逆(N2 O5 ) d.气体的平均相对分子质量为43.2,且保持不变
(3)将2molN2 和4mo1H2 置于lL的恒容密闭容器中反应。测得不同温度、不同时间段内合成NH3 反应中N2 的转化率,得到数据如下表:

表中a、b、25%三者由大到小的顺序为_____,理由是_____。
(4)将(3)中实验得到的混合气体通入醋酸溶液中并恢复到25℃,当两者恰好反应时,生成的CH3COONH4溶液呈中性,则25℃时NH3·H2O的电离平衡常数Kb=______(已知:25℃时0.18mol/LCH3COOH 溶液中c(H+)=1.8×10-3mol/L)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH________0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式________。
(3)实验步骤如下:
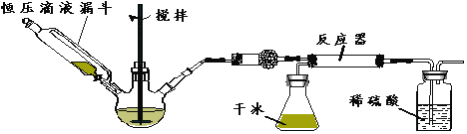
步骤1:按图所示组装仪器,检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是_________。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有______,_______。
③以恒压滴液漏斗代替分液漏斗的目的是________________。
④反应后期CO2气流量下降时,可采取的相应措施是______________。
(4)该实验装置中可能存在的缺陷是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com