
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
【答案】 100mL容量瓶 B 淀粉溶液 滴加最后一滴标准液,溶液由蓝色变为无色且半分钟内不恢复原色 17.92% bc
【解析】(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和100mL容量瓶。(2)Na2S2O3溶液显碱性,则Na2S2O3标准液应装在碱式滴定管中,即答案选B。(3)碘遇淀粉显蓝色,则指示剂应选用淀粉溶液,反应中单质碘被消耗,则判断达到滴定终点的现象是滴加最后一滴标准液,溶液由蓝色变为无色且半分钟内不恢复原色。(4)根据表中数据可知三次滴定消耗标准液体积分别是19.90mL、20.00mL、20.10mL,所以消耗标准液体积的平均值是20.00mL。根据方程式5CO+I2O5![]() 5CO2+I2、2Na2S2O3+I2=2NaI+Na2S4O6可知5CO~I2~2Na2S2O3,则气体样品中CO的体积分数为
5CO2+I2、2Na2S2O3+I2=2NaI+Na2S4O6可知5CO~I2~2Na2S2O3,则气体样品中CO的体积分数为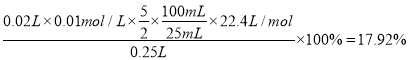 ;(5)a.滴定终点俯视读数,读数偏小,结果偏低,a错误;b.锥形瓶用待测溶液润洗,消耗标准液体积增加,结果偏高,b正确;c.滴定前有气泡,滴定后没有气泡,消耗标准液体积增加,结果偏高,c正确;d.配制100 mL待测溶液时,有少量溅出,浓度偏低,消耗标准液体积减少,结果偏低,d错误,答案选bc。
;(5)a.滴定终点俯视读数,读数偏小,结果偏低,a错误;b.锥形瓶用待测溶液润洗,消耗标准液体积增加,结果偏高,b正确;c.滴定前有气泡,滴定后没有气泡,消耗标准液体积增加,结果偏高,c正确;d.配制100 mL待测溶液时,有少量溅出,浓度偏低,消耗标准液体积减少,结果偏低,d错误,答案选bc。


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
A.标准状况下,78g苯中含有碳氢键的数目为6NA
B.180g乙酸、葡萄糖的混合物所含碳原子数为6NA
C.1L0.1molL﹣1Na2S溶液中阴离子总数大于0.1NA
D.在密闭容器中通入3molH2和1molN2 , 充分反应后得到的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4Al2(SO4)32Al2O36H2O,含有少量氧化铁.利用明矾石制备K2SO4的工艺流程如图所示:
据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为;写出炉气的一种用途:;
(2)②中Al2O3参与反应的离子方程式为 .
(3)③中调节pH不能用CO2的理由是
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是
(5)纯净氢氧化铝经历两次(填反应类型)可制得铝.以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2 , 该电池负极的电极反应式是 .
(6)现有明矾石1625t,按上述流程制得780tAl(OH)3 , 忽略铝元素的损失,请计算明矾石中钾元素的质量分数为%.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
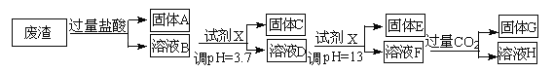
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol·L-1 )时的pH 如下表所
示。
阳离子 | Fe3+ | Al3+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol·L-1。
请回答下列问题:
(1)固体C为_________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是_________(填“氨水”或“氢氧化钠”),其理由是_________________。
(3)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________________。
(4)写出溶液F→溶液H 的离子方程式:__________________。
(5)Ksp[Mg (OH )2]=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份等体积、等物质的量浓度的NaOH溶液,分别与体积相等的MgCl2和AlCl3溶液混合,充分反应后,Mg2+、Al3+均恰好完全形成沉淀,则原MgCl2、AlCl3溶液中Cl—浓度之比为( )
A.1:1B.1:2C.2:3D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4SO3)、硫代硫酸(H2S2O3)等等,在工业上有广泛的应用.它们对应的钠盐同样也是重要的化工产品.
(1)(一).硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解.工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程.
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
①烧瓶A中发生反应的离子方程式为: . 装置D的作用是 .
②装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 .
a.蒸馏水 b.饱和Na2SO3溶液c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
③反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有 .
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
④为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是 .
(2)(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.Na2S2O5溶于水即生成NaHSO3 . ①证明NaHSO3溶液中HSO3﹣的电离程度大于水解程度,可采用的实验方法是(填序号).
a.测定溶液的pH b.加入Ba(OH)2溶液c.加入盐酸d.加入品红溶液 e.用蓝色石蕊试纸检测
②葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
葡萄酒样品100.00mL ![]() 馏分
馏分 ![]() 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色
方程式为SO2+I2+2H2O=H2SO4+2HI)按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为gL﹣1 . 上述实验过程中,若有部分HI被空气氧化,则测得结果(填“偏高”“偏低”或“不变”).其原因是(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)N2(g)+2CO2(g).请回答下列问题:
(1)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的 ![]() .
.
①该反应的平衡常数K=(用只含a、V的式子表示)
②判断该反应达到平衡的标志是(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(2)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:
①有害气体NO的转化率是 , 0~15minCO2的平均反应速率v(CO2)= . (保留小数点后三位)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 . (填序号).
A.增加CO的量 B.加入催化剂C.减小CO2的量 D.扩大容器体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。下列有关麦考酚酸说法正确的是( )
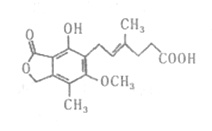
A. 分子式为C17H23O6
B. 不能与FeC13溶液发生显色反应
C. 在一定条件下可发生加成、取代、消去反应
D. l mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温室效应引起国际的关注,我国也积极应对,采取措施。中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法合理的是( )
A.聚二氧化碳塑料是通过加聚反应制得的
B.聚二氧化碳塑料与干冰互为同素异形体
C.聚二氧化碳塑料的使用也会产生白色污染
D.聚二氧化碳塑料与干冰都属于纯净物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com