
【题目】下列说法正确的是
A.摩尔是国际单位制中的七个基本物理量之一
B.1molO2中约含有6.02×1023个O2
C.1mol任何物质都含有6.02×1023个原子
D.摩尔表示物质的量
科目:高中化学 来源: 题型:
【题目】树德中学高2016级研宄性学习小组请你参与“研究铁与水反应所得固体物质的成分,性质及再利用”实验探宄,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验

(1)硬质玻璃管中发生反应的化学方程式为__________________。
(2)反应前A中投放碎瓷片的日的是__________________。
(3)装置E中的现象是__________________。
探究二 设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)硬质玻璃管B冷却后,取少许其中的固体物质溶于后,将所得溶液分成两份。
(5)一份滴加儿滴KSCN溶液。若溶液变m红色,推断硬质玻璃管B中固体物质的成分为______________(选填序号,①一定有Fe3O4 ②一定有Fe ③只有Fe3O4④只有Fe,下同);若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为______________。
(6)另—份用胶头滴管加入_______________,若出现______________现象,可以证明溶液中存在Fe2+,其反应的离子方程式是_____________。
探究三 设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。

(7)试剂b的化学式是_________。
(8)计算反应后B装置中铁元素的质量分数为_______________。(保留小数点后—位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关“电离平衡”的叙述正确的是( )
A. 电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等
B. 电离平衡时,由于分子和离子的浓度不再发生变化,所以说电离平衡是静态平衡
C. 弱电解质达到电离平衡后,各种离子的浓度一定相等
D.电离平衡是相对的、暂时的、外界条件改变时,平衡就会发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是
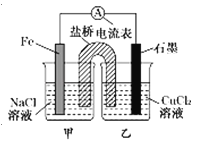
A.原电池的总反应为Fe+Cu2+═Fe2++Cu
B.盐桥中是KNO3溶液,则盐桥中NO3﹣移向乙烧杯
C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e﹣═H2↑
D.反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A.上述反应在较高温度下才能自发进行
B.该反应的正反应活化能小于逆反应活化能
C.该反应中,断裂化学键的总键能大于形成化学键的总键能
D.若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质。用硼泥生产氢氧化镁的工艺流程如下图所示:
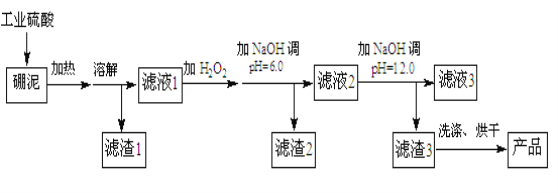
已知某些氢氧化物沉淀的pH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Al(OH)3 | 4.1 | 5.4 |
Fe(OH)3 | 2.7 | 3.7 |
(1)MgO的电子式为 ,加入H2O2的目的是______________。
(2)滤渣2的主要成分是 ,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为 。
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为 。
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为 。
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)2产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为 (用含有a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制印刷电路时常用氯化铁溶液作为“腐蚀液”。铜被氯化铁溶液腐蚀的方程式为B2FeCl3+Cu![]() 2FeCl2+CuCl2;FeCl3 溶液也能与铁反应2FeCl3+Fe
2FeCl2+CuCl2;FeCl3 溶液也能与铁反应2FeCl3+Fe![]() 3FeCl2;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是
3FeCl2;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是
A.有铜无铁 B.有铁无铜 C.有铁有铜 D.无铁无铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构和性质】 砷的一些化合物常用作半导体、除草剂、杀鼠药等,回答下列问题:
(1)写出基态砷原子的电子排布式_________________;有_________________个未成对电子。
(2)稼氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大到小的顺序是____________;
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为______________,1mol As4O6含有![]() 键的物质的量为____________mol。
键的物质的量为____________mol。

(4)As与N是同族元素,AsH3的沸点比NH3的沸点 ,原因是 。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据结构与性质的关系,H3AsO4的酸性比H3AsO3强的原因是: 。
(6)晶胞有两个基本要素
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子坐标参数A处Li为(0,0,1/2);B处As为(1/4,1/4,1/4);C处Li的坐标参数为 。
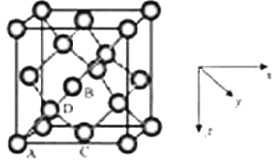
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数,a=594pm,NA表示阿伏伽德罗常数的数值,其密度为 gcm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com