
����Ŀ��������Ҫ��MgO��SiO2��ɣ���������Fe2O3��FeO��Al2O3�����ʡ�����������������þ�Ĺ�����������ͼ��ʾ��
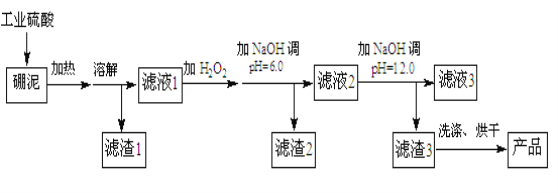
��֪ijЩ�������������pH���±���ʾ��
�������� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Mg��OH��2 | 9.3 | 10.8 |
Fe��OH��2 | 7.6 | 9.6 |
Al��OH��3 | 4.1 | 5.4 |
Fe��OH��3 | 2.7 | 3.7 |
��1��MgO�ĵ���ʽΪ ������H2O2��Ŀ����______________��
��2������2����Ҫ�ɷ��� ��������2�м������������NaOH��Һ��������Ӧ�����ӷ���ʽΪ ��
��3������NaOH������ҺpH=12.0ʱ��������Ӧ�����ӷ���ʽΪ ��
��4������Mg��OH��2�뺬SO2��������Ӧ����MgSO4������ʹ�������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��5����ȡa������Ϊԭ�ϣ����õ�b��Mg��OH��2��Ʒ����������������þԪ������ʧ������������MgO����������Ϊ ���ú���a��b�Ĵ���ʽ��ʾ����
���𰸡�
��1��![]() ��Fe2������ΪFe3��
��Fe2������ΪFe3��
��2��Fe(OH)3��Al(OH)3 Al(OH)3+OH��=[Al(OH)4]-
��3��Mg2��+2OH��=Mg(OH)2��
��4��2Mg(OH)2+2SO2 +O2 =2MgSO4+2H2O
��5��![]() ��100%
��100%
��������
�����������1��MgO�����ӻ��������ʽΪ![]() ��Fe2�����л�ԭ�ԣ�H2O2���������ԣ����Լ���H2O2��Ŀ���ǽ�Fe2������ΪFe3����
��Fe2�����л�ԭ�ԣ�H2O2���������ԣ����Լ���H2O2��Ŀ���ǽ�Fe2������ΪFe3����
��2��MgO��Fe2O3��FeO��A12O3�����������ᣬ����1��SiO2������˫��ˮ�������ٵ�����ҺpH=6ʱ���������Ϣ������2��Fe(OH)3��Al(OH)3��������NaOHʱ��Al(OH)3�ܽ⣬������Ӧ�����ӷ���ʽΪAl(OH)3+OH��=[Al(OH)4]-��
��3��������ҺpH=12��0ʱ��Mg��������������Ӧ�����ӷ���ʽΪMg2��+2OH��=Mg(OH)2����
��4���÷�Ӧһ���������μӣ���ѧ����ʽ��2Mg(OH)2+2SO2 +O2 =2MgSO4+2H2O��
��5����MgO����������Ϊx������Mg�غ㣬b/56=ax/40����ã�x=![]() ��100%��
��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�������ͺ��Ȼ�����Һ ��39%���Ҵ���Һ ���Ȼ��ƺ͵������ˮ��Һ���������ϸ����Һ����ȷ����������
A����Һ����ȡ������ B����ȡ������Һ
C����Һ��������ȡ D��������ȡ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״��ȿ����ڻ����л�ԭ�ϣ��ֿ���Ϊȼ�������������ȼ�ϡ�
��1�������ǹ�ҵ�Ϻϳɼ״���������Ӧ��
��ӦI�� CO��g����2H2��g��![]() CH3OH��g�� ��H1
CH3OH��g�� ��H1
��ӦII��CO2��g����3H2��g��![]() CH3OH��g��+ H2O��g�� ��H2
CH3OH��g��+ H2O��g�� ��H2
�� ������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� ���I����II������
�� �±����������Ƿ�ӦI�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ɱ��������жϷ�ӦIΪ______________�ȷ�Ӧ��������š�����
�� ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0��2 mol/L����CO��ת����Ϊ ����ʱ���¶�Ϊ ���ӱ���ѡ��
��2�� ��֪�ڳ��³�ѹ�£�
��2CH3OH��l����3O2��g����2CO2��g����4H2O��g�� ��H1 kJ/mol
��2CO��g��+O2��g����2CO2��g�� ��H2 kJ/mol
��H2O��g����H2O��l�� ��H3 kJ/mol
��Ӧ CH3OH��l��+ O2��g���� CO��g��+ 2H2O��l�� ��H�� kJ/mol
��3�����Լ״�ȼ�ϵ�أ����õ�ⷨ���������Ժ�����ˮ(��Ҫ����Cr2O72)ʱ��ʵ����������ͼװ��ģ��÷���
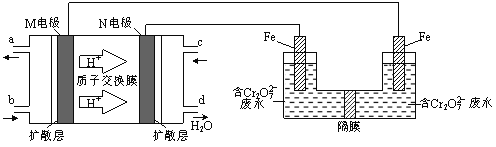
�� N�缫�ĵ缫��ӦʽΪ ��
�� ����ɵ�����Cr2O72ת��ΪCr3+�����ӷ�Ӧ����ʽ��
Cr2O7 2+ Fe2+ + [ ] �T Cr3++ Fe3++ [ ]
��4�� ������ˮʱ�����Cr3+��Cr(OH)3��ʽ��ȥ����c(Cr3+)=1��105 molL��1 ʱ��Cr3+������ȫ����ʱ��Һ��pH= �� (��֪�� Ksp[Cr(OH)3]=6.4��1031��lg2=0.3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��Ħ���ǹ��ʵ�λ���е��߸�����������֮һ
B��1molO2��Լ����6.02��1023��O2
C��1mol�κ����ʶ�����6.02��1023��ԭ��
D��Ħ����ʾ���ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϡ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ��������ºϳɼ״�������������Ӧ���£�
��CO(g)+2H2(g)=CH3OH(g) ��H1
��CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ��H2
��CO2(g)+H2(g)=CO(g)+H2O(g) ��H3
�ش��������⣺
��1����֪��Ӧ������صĻ�ѧ�������������£�
![]()
�ɴ˼����H1=kJ.mol-1��
��֪����H2=-58kJ.mol-1�����H3=kJ.mol-1
(2)��Ӧ�ٵĻ�ѧƽ�ⳣ��K�ı���ʽΪ_____________��ͼ1������ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ____________(�����߱����ĸ)�����ж�������____________��
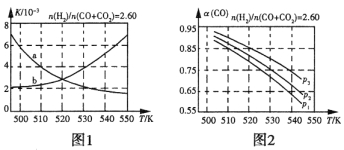
(3)�ϳ��������n(H2)/n(CO+CO2)=2.60ʱ��ϵ�е�COƽ��ת����(a)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ��a(CO)ֵ���¶����߶�_____________(�����С��)����ԭ����_____________��ͼ2�е�ѹǿ�ɴ�СΪ___________�����ж�������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����м������ʵķ������ܴﵽĿ���ǣ� ��
A.�õ�ˮ���������Һ��������Һ
B.�����Ը��������Һ������ϩ����Ȳ
C.����ˮ�������Ȼ�̼�ͱ�������ɫҺ��
D.�ý����Ƽ����Ҵ�������ѣ�CH3OCH3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ϸ����Ԫ�غͻ�������������������
A. ���ϸ�������к������Ļ�ѧԪ����̼
B. ������֬��ATP��DNA�Ȼ���������Ԫ�أ������������Ĵ���Ԫ��
C. �����塢Ҷ����ͺ������ж��ܲ���ˮ
D. ��ϸ����һ���У�ϸ���е�����ˮ/���ˮ��ֵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ϸ����̼Ԫ�ص�˵������ȷ����
A. ̼��ռ����ϸ����������Ԫ��
B. ���ᡢ��֬�������ʾ���̼Ԫ��
C. ����ϸ���Ļ��������̼��Ϊ�Ǽ�
D. ̼����ϸ���е���Ԫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com