
【题目】研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为2Li+2H2O=2LiOH+H2↑
(1)该电池的负极是__,负极反应式是__。
(2)正极现象是__。
科目:高中化学 来源: 题型:
【题目】绿色农药——信息素的推广使用,对环保有重要意义。有一种信息素的结构简式为![]() 。下列关于检验该信息素中官能团的试剂和顺序正确的是( )
。下列关于检验该信息素中官能团的试剂和顺序正确的是( )
A. 先加入酸性高锰酸钾溶液,后加银氨溶液,水浴加热
B. 先加入溴水,后加酸性高锰酸钾溶液
C. 先加入新制氢氧化铜悬浊液,加热,酸化后再加入溴水
D. 先加入银氨溶液,再另取该物质加入溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.Al在氧气中燃烧生成A12O3 , 将Al片改成Al粉
B.Fe与稀硫酸反应制取H2时,该用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.Na与水反应时增大水的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释. 100 倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为________ mol·L1(计算结果保留 2位有效数字)。
(2)某同学取 100mL 该“84消毒液” ,稀释后用于消毒,稀释后的溶液中n(Na+)=_______ mol.
(3)“84消毒液”与稀硫酸混合用可增强消毒能力,某消毒小组用98%(ρ=1.84g·cm-3)的浓硫酸配制2L 2.3mol·L-1的稀硫酸,用于增强“84消毒液”的消毒能力,需用浓硫酸的体积为_______mL。
(4)“84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。实验室用密度为1.25 g·mL-1,质量分数36.5%的浓盐酸配制0.1 mol·L-1的盐酸240 mL。
①配制240 mL 0.1 mol·L-1的盐酸应选用______mL的容量瓶。
②下列操作对所配溶液的浓度有何影响 (填“偏大”、“偏小”或“无影响”)。
A.定容时,俯视刻度线,浓度 ____________ ;
B.用量筒量取浓盐酸时,仰视刻度线,浓度 __________ ;
C.定容摇匀后发现溶液凹面低于刻度线,加水至刻度线,浓度 ____________ 。
D.容量瓶在使用前未干燥,里面有少量蒸馏水, 浓度 ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下
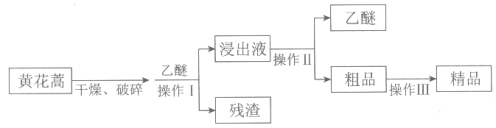
(1)操作I、II中,不会用到的装置是________(填序号)。

(2)向干燥、破碎后的黄花蒿中加入乙醚的作用是________。
(3)操作III的目的是_________。
(4)如图是几种实验中常用的仪器:

写出序号所代表的仪器的名称:
A.__________;B.__________;C.__________;D.__________;E.__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂周围的空气含有较多二氧化硫,某化学兴趣小组设计了以下装置和方法测定空气(内含N2、O2、SO2、CO2等)中SO2含量。
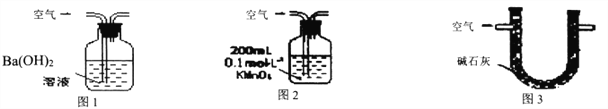
甲.用图1所示装置,通入V升空气,测定生成沉淀的质量
乙.用图2所示装置,当KMnO4溶液刚好褪色时,测定通入空气的体积V
丙.用图3所示装置,通入V升空气,测定U型管增加的质量
(1)你认为可行的操作是________。(填“甲、乙、丙”)
(2)某环保部门为了测定空气中SO2含量,做了如下实验:取标准状况下的空气VL,缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①若通入气体的速率过快,则测定的SO2的体积分数_______。(选填“偏高”、“偏低”或“不受影响”)。
②如何判断氯化钡溶液已经加过量_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料的加工说法正确的是( )
A.煤的气化和液化是物理变化,是高效、清洁地利用煤的重要途径
B.石油分馏是化学变化,可得到汽油、煤油、柴油等
C.石蜡油高温分解的产物中含有烷烃和烯烃
D.石油催化裂化主要得到乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学降解NO2— 的原理如图,下列有关说法正确的是

A. 直流电源的负极是A电极
B. 阳极反应式为:2NO2-+6e +8H+ =N2↑+4H2O
C. 电解过程中H+将从右到左通过质子交换膜
D. 当电解过程中转移了6mol电子时,两极共产生2.5mol的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在一定体积pH = 12的NaOH溶液中, 加入一定体积0.01 mol/L的NaHSO4溶液,此时混合溶液的pH = 11。若反应后溶液的体积等于NaOH 溶液与NaHSO4溶液的体积之和,则NaOH溶液与NaHSO4溶液的体积比是( )
A. 1∶9 B. 10∶1 C. 11∶9 D. 1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com