
����Ŀ�������仯����������������Ӧ�ù㷺�������죨Fe2O3������Ϊ���ϣ����ӹ�ҵ����һ��Ũ�ȵ�FeCl3��Һ��ʴ����ͭ���ľ�Ե�壬�Ƴ�ӡˢ��·�塣 aFe2��SO4�� 3��b��NH4�� 2SO4��cH2O����������泥���������������ˮ����ҵѭ��ˮ�ľ���������
��1������һ����Fe2O3��Fe3O4�Ļ������Ʒ�����n��Fe��:n��O��=1:1.375,�����Ʒ��Fe2O3�����ʵ�������Ϊ___________�����������2λ��Ч���֣�
��2��CuO��Fe2O3�Ļ����9.6 g�ڸ�������������CO��ַ�Ӧ����Ӧ��ȫ��������100mL 1.2mol/L Ba��OH��2 ��Һ���գ�����15.76 g��ɫ�������������������Һ�е����ʵĻ�ѧʽΪ__________���������CuO��Fe2O3�����ʵ���֮��Ϊ___________��
��3����ȡij���������Ʒ7.00 g����������ˮ���Ƴ�100 mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�1.07 g����������һ����Һ�м��뺬0.025 molBa ��NO3��2����Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽ_________��
��4���ֽ�һ�����ͭ���ľ�Ե�����800mL 3mol/L��FeCl3��Һ�У�һ��ʱ�������·��ȡ��������Һ�м�������56.0 g����ַ�Ӧ��ʣ�����51.2 g����������Һ�����ʵ����ʵ���Ũ��_________�����Է�Ӧǰ����Һ����ı仯����
���𰸡�33% Ba(HCO3)2 1:1 Fe2��SO4��32��NH4��2SO42H2O FeCl2 4.25 mol/L��CuCl2 0.25 mol/L
��������
��1����Fe2O3��Fe3O4�Ļ��������ʵ����ֱ���x��y����n(Fe):n(O)=(2x+3y):(3x+4y)=1:1.375����x:y=1:2�������Ʒ��Fe2O3�����ʵ�������Ϊ![]() =33%���ʴ�Ϊ��33%��
=33%���ʴ�Ϊ��33%��
��2��100mL1.2mol/LBa(OH)2�����ʵ���Ϊ0.12mol������15.76g��0.08mol��ɫ����̼�ᱵ����������̼���㣬����̼Ԫ���غ㣬�����Ķ�����̼��0.08mol����ʱ���ݻ�����������㣬���ɵĶ�����̼�϶�����0.08mol���ʶ�����̼��������ʱ��Һ������ΪBa(HCO3)2����Ba(OH)2+ CO2 = BaCO3��+H2O��BaCO3+ CO2+H2O = Ba(HCO3)2�ã�����̼ԭ���غ��n(CO2)=0.08mol+(0.012mol-0.08mol)��2=0.16mol����������CuO��Fe2O3�����ʵ����ֱ�Ϊxmol��ymol����x+3y=0.16��80x+160y=9.6�����x=0.04mol��y=0.04mol�����Ի������CuO��Fe2O3�����ʵ���֮��Ϊ1:1���ʴ�Ϊ��Ba(HCO3)2��1:1��
��3����ȡ7.00g��Ʒ����������ˮ���ó�100mL��Һ,�ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�1.07g������ӦΪFe(OH)3��n(Fe(OH)3)=![]()
![]() =0.01mol������һ����Һ�м���0.025molBa(NO3)2��Һ��ǡ����ȫ��Ӧ����n(SO42)=0.025mol������7.00g��Ʒ�к���Fe2(SO4)30.01mol�����к���n(SO42)Ϊ0.05mol����(NH4)2SO4Ϊ0.05mol0.01��3mol=0.02mol����m(H2O)=7.00g0.01mol��400g/mol0.02mol��132g/mol=0.72g��n(H2O)=
=0.01mol������һ����Һ�м���0.025molBa(NO3)2��Һ��ǡ����ȫ��Ӧ����n(SO42)=0.025mol������7.00g��Ʒ�к���Fe2(SO4)30.01mol�����к���n(SO42)Ϊ0.05mol����(NH4)2SO4Ϊ0.05mol0.01��3mol=0.02mol����m(H2O)=7.00g0.01mol��400g/mol0.02mol��132g/mol=0.72g��n(H2O)=![]() =0.04mol��n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.01:0.02:0.02=1:2:2�����Ի�ѧʽΪFe2��SO4��32��NH4��2SO42H2O���ʴ�Ϊ��Fe2��SO4��32��NH4��2SO42H2O��
=0.04mol��n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.01:0.02:0.02=1:2:2�����Ի�ѧʽΪFe2��SO4��32��NH4��2SO42H2O���ʴ�Ϊ��Fe2��SO4��32��NH4��2SO42H2O��
��4���Ȼ����ܽ�ͭ�����Ȼ��������Ȼ�ͭ����Ӧ����Һ��Һ�м������ۣ�ʣ���������С��Fe�۵����������ܽ�Cu����Һ�л���ʣ���FeCl3�����������ȷ�����2Fe3++Fe=3Fe2+��Ȼ������Fe+Cu2+=Fe2++Cu�������й���ʣ�࣬��Fe3+��ȫ��Ӧ����Һ�к�������FeCl2�����跴Ӧ����Һ��û��CuCl2�������������غ��֪��Һ��FeCl2Ϊ![]() =3.6mol��������FeӦΪ3.6mol0.8L��3mol/L=1.2mol����ʵ�ʼ���FeΪ
=3.6mol��������FeӦΪ3.6mol0.8L��3mol/L=1.2mol����ʵ�ʼ���FeΪ![]() =1mol<1.2mol������Һ��һ������CuCl2������Feԭ���غ㣬��Һn(FeCl2)=n(FeCl3)+n(Fe)=0.8L��3mol/L+1mol=3.4mol������Һc(FeCl2)=
=1mol<1.2mol������Һ��һ������CuCl2������Feԭ���غ㣬��Һn(FeCl2)=n(FeCl3)+n(Fe)=0.8L��3mol/L+1mol=3.4mol������Һc(FeCl2)=![]() =4.25mol/L�������������غ㣬n(CuCl2)=
=4.25mol/L�������������غ㣬n(CuCl2)=![]() ��(0.8L��3mol/L��33.4mol��2)=0.2mol������Һc(CuCl2)=
��(0.8L��3mol/L��33.4mol��2)=0.2mol������Һc(CuCl2)=![]() =0.25mol/L���ʴ�Ϊ��FeCl2 4.25 mol/L��CuCl2 0.25 mol/L��
=0.25mol/L���ʴ�Ϊ��FeCl2 4.25 mol/L��CuCl2 0.25 mol/L��


 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����˽̰�̲�ʵ�顰��200mL�ձ��з���20g���ǣ�C12H22O11������������ˮ��������ȣ�Ȼ���ټ���15mL��������Ϊ98%Ũ���ᣬѸ�ٽ��衱��������̽����
��1���۲����������ȱ�ƣ�����ڣ�������ͣ��γ����ɶ�ĺ���״��ɫ���ʣ�ͬʱ�ŵ��̼�����ζ����ѹ�˺�ɫ����ʱ���о���Ӳ������ˮ�г�Ư��״̬��ͬѧ�������������Ʋ�����н��ۣ�
��Ũ�������ǿ������ ��Ũ���������ˮ�� ��Ũ���������ˮ�Ԣ�Ũ����������� �ݺ�ɫ���ʾ���ǿ������
�������ݲ���ֵ���_________������ţ���
��2��Ϊ����֤������Ũ���ᷴӦ���ɵ���̬���ͬѧ�����������װ�ã�

�Իش��������⣺
��ͼ1��A�����ѡ������װ��_________�����ţ���
��ͼ1�� Bװ����װ�Լ���_________��Dװ�����Լ���������_________��Eװ���з�����������_________��
��ͼ1��Aװ����ʹ�����ȱ�ڵĻ�ѧ��Ӧ����ʽΪ_________����������͵Ļ�ѧ����ʽΪ��_________��
��ijѧ����ͼ2����ʵ��ʱ������DƿƷ�첻��ɫ��Eװ�����������ݳ���Fװ�������Ը��������Һ��ɫ��dz���Ʋ�Fװ�������Ը��������Һ��ɫ��dz��ԭ��_________���䷴Ӧ�����ӷ���ʽ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ��������У���¯��ԭ�Ϸ�������Ҫ��ӦΪ��2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+CO2��
2Na2SiO3+CaSiO3+CO2��
��1��ij��Ӧ��������״̬�²����磬������___���塣
��2��������Ӧ�����漰�Ķ�����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ___��
��3��̼������ͬ��Ԫ�أ�����Ԫ�ص�ԭ�����������ʾʽΪ___��
��4��дһ���ܱȽ�̼Ԫ�غ���Ԫ�طǽ�����ǿ���Ļ�ѧ��Ӧ����ʽ��___��
��5��CO2�ĵ���ʽΪ___��
��6����Ӧ��Na2CO3��CaCO3�����Ʊ�������̼�������������Ƕ���ʹ��ϡ���ᣬ��˵�����ɣ�___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʳ��ˮ��ȡClO2�Ĺ�ҵ������ͼ��ʾ��

װ�â��еķ�Ӧ��![]()
װ�â��еķ�Ӧ��![]()
���й��ڸ����̵�˵����ȷ����
A.�������н�NaCl��ѭ������
B.װ�â���H2����������
C.װ�â���Cl2�ǻ�ԭ����
D.ΪʹH2��ȫת��ΪHCl����Ӧ��װ�â����ٲ���Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʪ�����ֳ�Ϊ����������������������Һ��ͨ����������������ͬʱ�õ������ԭ����ͼ��ʾ��ͼ��HA��ʾ������ӣ�A����ʾ��������ӣ��� ����˵����ȷ���ǣ� ��.
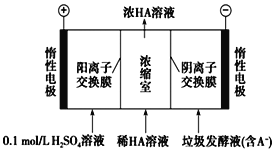
A.����11.2LO2����ʱ����·��ͨ��2 mol e���ĵ���
B.���ӴӸ������������Һ�ص�����
C.ͨ���A��ͨ�������ӽ���Ĥ������������Ũ����
D.ͨ�����������pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ��ϡH2SO4���ձ��з����õ������ӵĵ缫X��Y�����·�е�����������ͼ��ʾ������˵����ȷ����
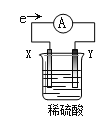
A.���·�ĵ�������Ϊ��X�����·��Y
B.X���Ϸ������ǻ�ԭ��Ӧ
C.��Һ����������X���ƶ�
D.�����缫���ǽ����������ǵĻ��˳��ΪX��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ���SO2��ȥԭ����������CO������ΪS������CO2��
(1)д���÷�Ӧ�Ļ�ѧ����ʽΪ__________________________________________
(2)������Ӧ�У�ÿ����2.24L���壨��״���£�ת�Ƶ�����Ϊ________________��
(3)������Ӧ���漰������Ԫ����ԭ�Ӱ뾶�Ӵ�С������˳��Ϊ______________������Ԫ�طǽ�������ǿ������˳��Ϊ__________________����Ӧ���漰�Ļ������н���һ���ǷǼ��Է��ӣ������ʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵؿ��к������Ľ���Ԫ�أ������仯�������ճ������ҵ���й㷺��Ӧ�á�
(1)��ԭ�Ӻ�����_________�ֲ�ͬ�˶�״̬�ĵ��ӣ���_________��������ͬ�ĵ��ӣ�д������Ԫ�����ڱ��е�λ�ã�________
(2)����������ǿ�ȸߣ���ĥ������ʴ���۵�ɴ�2200�档�Ʋ������________���壬�ԱȽ���ɸ����ʵ������뾶��С��_______
(3)����������������Ӧ���Ʊ���������4BaO+2Al![]() BaO��Al2O3+3Ba������Ҫԭ����_______(ѡ����)��
BaO��Al2O3+3Ba������Ҫԭ����_______(ѡ����)��
a.Al�����Դ���Ba b.Ba�е��Al�ĵ� c.BaO��Al2O3��Al2O3�ȶ�
(4)��ҵ��������������������̼������ȡ����ʯ(Na3AlF6)���䷴Ӧ����������Ԫ�������ڱ���λ�����ڣ��ɱȽ����ǽ����Ի�ǽ�����ǿ������_________(ѡ����)��
a.��̬�⻯����ȶ��� b.����������Ӧˮ�������(��)��
c.������������Ӧ������ d.������ͬŨ���ᷢ����Ӧ�Ŀ���
(5)������ҵ�ϲ��õ���Ȼ��������õ���������ķ�����������ʵ�ԭ��_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪2molH2��ȫȼ������ˮ�����ų�����484kJ����1molH-H������ʱ��������Ϊ436kJ��1molO=O������ʱ��������Ϊ496kJ����ˮ������1molH-O���γ�ʱ�ų�������Ϊ_____��
��2����˹������Ϊ�����ܻ�ѧ������һ����ɻ�ּ�����ɣ��������̵�����ЧӦ��ͬ�������ø�˹���ɻش��������⣺
��֪��H2O(g) === H2O(l) ��H1= ��Q1 kJ/mol
C2H5OH(g) === C2H5OH(l) ��H2= ��Q2 kJ/mol
C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ��H3= ��Q3 kJ/mol
��ʹ46gҺ̬��ˮ�ƾ���ȫȼ�գ����ָ������£������������зų�������Ϊ____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com