
【题目】(1)已知2molH2完全燃烧生成水蒸气放出热量484kJ,且1molH-H键断裂时吸收热量为436kJ,1molO=O键断裂时吸收热量为496kJ,则水蒸气中1molH-O键形成时放出的热量为_____。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g) === H2O(l) ΔH1= —Q1 kJ/mol
C2H5OH(g) === C2H5OH(l) ΔH2= —Q2 kJ/mol
C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ΔH3= —Q3 kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________。
【答案】463kJ (3Q1-Q2+Q3)kJ
【解析】
(1)2mol氢气完全燃烧生成水蒸气时放出热量484kJ,则:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,设1molH-O键形成时放出的热量为x kJ,则:484kJ=4×463kJ-(436kJ×2+496 kJ),解得x=463kJ。故1molH-O键形成时放出的热量为463kJ。
(2)①H2O(g) === H2O(l) ΔH1= —Q1 kJ/mol
②C2H5OH(g) === C2H5OH(l) ΔH2= —Q2 kJ/mol
③C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ΔH3= —Q3 kJ/mol,
依据盖斯定律,![]() ,可得C2H5OH(l) + 3O2(g) === 2CO2(g) +3H2O(l) ΔH= —(3Q1-Q2+Q3) kJ/mol,46g无水酒精物质的量为
,可得C2H5OH(l) + 3O2(g) === 2CO2(g) +3H2O(l) ΔH= —(3Q1-Q2+Q3) kJ/mol,46g无水酒精物质的量为![]() ,故46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量(3Q1-Q2+Q3)kJ。
,故46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量(3Q1-Q2+Q3)kJ。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活中应用广泛,如铁红(Fe2O3)可作为颜料,电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。 aFe2(SO4) 3·b(NH4) 2SO4·cH2O,(硫酸铁铵)常用于生活饮用水、工业循环水的净化处理。
(1)现有一含有Fe2O3和Fe3O4的混合物样品,测得n(Fe):n(O)=1:1.375,则该样品中Fe2O3的物质的量分数为___________。(结果保留2位有效数字)
(2)CuO和Fe2O3的混合物9.6 g在高温下与足量的CO充分反应,反应后全部气体用100mL 1.2mol/L Ba(OH)2 溶液吸收,生成15.76 g白色沉淀。则吸收气体后溶液中的溶质的化学式为__________,混合物中CuO和Fe2O3的物质的量之比为___________。
(3)称取某硫酸铁铵样品7.00 g,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到1.07 g沉淀;向另一份溶液中加入含0.025 molBa (NO3)2的溶液,恰好完全反应,求该硫酸铁铵的化学式_________。
(4)现将一块敷有铜箔的绝缘板浸入800mL 3mol/L的FeCl3溶液中,一段时间后,将该线路板取出,向溶液中加入铁粉56.0 g,充分反应后剩余固体51.2 g,求所得溶液中溶质的物质的量浓度_________(忽略反应前后溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:①反应I:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
②H2(g)+![]() O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)═H2O(g) ΔH3=+44.0 kJ·mol-1
则反应2NH3(g)![]() N2(g)+3H2(g)的反应热△H=___。
N2(g)+3H2(g)的反应热△H=___。
(2)合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |

①△H2_____(填“>”“<”或“=”)0。
②下列说法正确的是_______(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=___(保留三位小数)。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡__(填“正向”、“逆向”或“不”)移动。
(3)体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是在明矾溶液中滴入氢氧化钡溶液,下列说法错误的是( )

A. OA段的反应离子方程式为:2Al3++3SO![]() +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
B. AB段的离子方程式只有:Al(OH)3+OH-===AlO![]() +2H2O
+2H2O
C. A点的沉淀为Al(OH)3和BaSO4的混合物
D. B点溶液为KAlO2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如下:
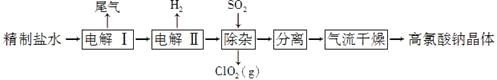
(1)由粗盐(含Ca2+、Mg2+、SO42-、Br-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。Na2CO3的作用是____________;除去盐水中的Br-可以节省电解过程中的电能,其原因是________________。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有______________(填化学式)。“电解Ⅱ”的化学方程式为_____________________。
(3)“除杂”的目的是除去少量的NaClO3杂质,该反应的离子方程式为_______________________。“气流干燥”时,温度控制在80~100 ℃的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:_________________________________。
②方法2:用氨水将SO2转化为NH4HSO3,再氧化为( NH4)2SO4。
实验测得NH4HSO3溶液中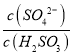 = 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g)![]() H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________
(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(s) ![]() COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)=H2S(g)+ CO(s)的平衡常数K=__________。
COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)=H2S(g)+ CO(s)的平衡常数K=__________。
T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为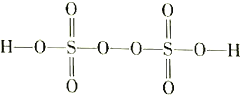 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生如下反应:![]() ,达到平衡后测得A气体的浓度为
,达到平衡后测得A气体的浓度为![]() ,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为
,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为![]() ,则下列叙述正确的是
,则下列叙述正确的是![]()
![]()
A.平衡向正反应方向移动B.![]()
C.B的物质的量浓度减小D.C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式正确的是( )
A.用铁丝网作电极,电解饱和食盐水:2Cl﹣+2H2O![]() 2OH﹣+Cl2↑+H2↑
2OH﹣+Cl2↑+H2↑
B.Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-→3BaSO4↓+2Al(OH)3↓
C.向H218O中投入Na2O2固体: 2H218O + 2Na2O2→ 4Na+ + 4OH-+ 18O2↑
D.石灰乳中Ca(OH)2的电离:Ca(OH)2(s) ![]() Ca2++ 2OH-
Ca2++ 2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com