
����Ŀ�����з���ʽ��ȷ����(�� ��)
A.����˿�����缫����ⱥ��ʳ��ˮ��2Cl��+2H2O![]() 2OH��+Cl2��+H2��
2OH��+Cl2��+H2��
B.Ba(OH)2��Һ�м��������Al2(SO4)3��Һ��3Ba2����6OH����2Al3����3SO42-��3BaSO4����2Al(OH)3��
C.��H218O��Ͷ��Na2O2���壺 2H218O + 2Na2O2�� 4Na+ + 4OH��+ 18O2��
D.ʯ������Ca(OH)2�ĵ��룺Ca(OH)2(s) ![]() Ca2��+ 2OH��
Ca2��+ 2OH��
���𰸡�B
��������
A���������缫����ⱥ��ʳ��ˮ����������ʧ���ӷ���������Ӧ�����ӷ���ʽΪ��Fe+2H2O![]() Fe(OH)2��+H2������A����
Fe(OH)2��+H2������A����
B��Ba(OH)2��Һ�м��������Al2(SO4)3��Һ�����߷�Ӧ�������ᱵ���������������ӷ���ʽΪ2Al3++6OH��+3Ba2++3SO42����3BaSO4��+2Al(OH)3������B��ȷ��
C����H218O��Ͷ��Na2O2���壬���ɵ���������������һ�뺬��18O�����ӷ���ʽΪ2H218O+2Na2O2��4Na++2OH��+218OH��+O2������C����
D��Ca(OH)2��ǿ����ʣ���ȫ�������ɸ����Ӻ����������ӣ����ӷ���ʽΪCa(OH)2(s)��Ca2++2OH������D����
�ʴ�ΪB��


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д� �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪2molH2��ȫȼ������ˮ�����ų�����484kJ����1molH-H������ʱ��������Ϊ436kJ��1molO=O������ʱ��������Ϊ496kJ����ˮ������1molH-O���γ�ʱ�ų�������Ϊ_____��
��2����˹������Ϊ�����ܻ�ѧ������һ����ɻ�ּ�����ɣ��������̵�����ЧӦ��ͬ�������ø�˹���ɻش��������⣺
��֪��H2O(g) === H2O(l) ��H1= ��Q1 kJ/mol
C2H5OH(g) === C2H5OH(l) ��H2= ��Q2 kJ/mol
C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ��H3= ��Q3 kJ/mol
��ʹ46gҺ̬��ˮ�ƾ���ȫȼ�գ����ָ������£������������зų�������Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڳ����·���ˮ��ʱ����Ӧ�����ӷ���ʽ��ȷ����
��NaHCO3��HCO3-��H2O![]() CO32-��H3O��
CO32-��H3O��
��NH4Cl��NH4+��H2O![]() NH3��H2O��H��
NH3��H2O��H��
��CuSO4��Cu2����2H2O![]() Cu(OH)2��2H��
Cu(OH)2��2H��
��NaF��F����H2O===HF��OH��
A. �٢�B. �ڢ�C. �٢�D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ԭ�ӵ��ӻ�������ͺͷ��Ӽ��ι��Ͳ���ȷ���ǣ�������
A.PCl3�� Pԭ��sp3�ӻ���Ϊ������
B.BCl3��Bԭ��sp2�ӻ���Ϊƽ��������
C.CS2��Cԭ��sp�ӻ���Ϊֱ����
D.H2S��Sԭ��sp�ӻ���Ϊֱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѹ㷺�������¡���ĥ���պ��������һ�ֵ����ѵ��Ʊ���ӦΪ��6TiCl4��8NH3=6TiN��24HCl��N2���ش��������⣺
��1������Ԫ�����ڱ��е�λ��Ϊ_____________����̬Tiԭ�Ӽ۲���ӵĹ������ʽΪ________��
��2������������Ԫ���γ������ӣ���NH4Cl�е�NH4+��N2O5�е�NO2+����������������ӵ�Ԫ���е�һ��������С�����˳��Ϊ____________��NH4+�Ŀռ乹��Ϊ___________��NO2+�е�ԭ�ӵ��ӻ���ʽΪ_______��������������������Ŀ��Ϊ_________��
��3�����Ȼ��Ѿ�����۵�Ϊ-23�棬�е�Ϊ136�棬��TiCl4���������Ϊ___________���þ�������֮���������Ϊ___________��
��4��һ��TiN���ɫ���徧���ṹ��NaCl��ͬ����ͼ�����þ�����Nԭ����ĿΪ_______���õ����ѵ��ܶ�Ϊ5.4g/cm3�����侧������a��___________pm����NA��ʾ�����ӵ³�������ֵ��ֻ����ʽ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǻ��õļ����Ԫ�أ��Ƽ��仯�������������������й㷺��Ӧ�á�������м��㣺
(1)��������(NaN3)��ײ����ȫ�ֽ�����ƺ͵������ʿ�Ӧ����������ȫ���ҡ�������40.32 L(��״����)������������Ҫ��������________ g��
(2)�����غϽ���ں˷�Ӧ���������Ƚ���Һ��5.05 g�����غϽ�����200 mLˮ����0.075 mol������
�ټ�����Һ�����������ӵ����ʵ���Ũ��(������Һ����仯)��________
�ڼ��㲢ȷ�����ƣ��غϽ�Ļ�ѧʽ��______________
(3)����������Һ�����������ˣ��õ��������Ƶ���Һ�������Һ��ͨ�������̼�������з�Ӧ��2NaAl(OH)4��CO2�D��2Al(OH)3����Na2CO3��H2O����֪ͨ�������̼336 L(��״����)������24 mol Al(OH)3��15 mol Na2CO3����ͨ����Һ�Ķ�����̼Ϊ112 L(��״����)���������ɵ�Al(OH)3��Na2CO3�����ʵ���֮�ȡ�_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��ѧ����Ԫ��ԭ�ӽṹ�����������ʾ��
��� | Ԫ�� | �ṹ������ |
A | A�����������г������������������Ȼ����Է����������35.5 | |
B | Bԭ���������������ڲ����������1/5 | |
�� | C | C�dz������ʵ���ҪԪ�أ����ʳ����³���̬ |
�� | D | D���ʱ���Ϊ����Ϣ�����Ĵ��������dz��õİ뵼����� |
�� | E | ͨ������£�Eû�������ϼۣ�A��B��C��D��F������E�γɻ����� |
�� | F | F�����ڱ��п������ڢ�A�壬Ҳ����������ڢ�A�� |
(1)AԪ�������ڱ��е�λ��Ϊ____________________________________________��
(2)B��C�γɵĻ�����Ļ�ѧʽΪ________��������________(��������������������)�����
(3)��F��E�����γ�ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1�����ֻ�����X��Y������X��Y��ˮ��Һ��ʵ�鷽����____________________
��F��C��ɵ����ֻ�����M��N�����ĵ������ֱ���X��Y��ȣ���M��ˮ��Һ��________�ԣ�N�ĽṹʽΪ________��
(4)C��E���ǽϻ��õķǽ���Ԫ�أ��û�ѧ����ʽ���������ֵ��ʵ�������ǿ��____��
(5)������ΪB��D�ĵ����õ������Ӻ�����Ȼ�����Һ�п����γ�ԭ��أ�����Ϊ�Ƿ���ԣ������ԣ���д�������ĵ缫����ʽ(����Ϊ���пɲ�д)___________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����軯�أ���ѧʽΪK3[Fe(CN)6]����ҪӦ������ҩ����ơ���ֽ�����������ȹ�ҵ�������շֽ�����KCN��FeC2��N2��(CN)2�����ʡ�
��1����Ԫ�������ڱ��е�λ��Ϊ_________����̬Fe3+ ��������Ų�ʽΪ_________��
��2����[Fe(CN)6]3�� �в����ڵĻ�ѧ����_________��
A. ���Ӽ� B.������ C.��� D. ���ۼ�
��3����֪(CN)2��������Cl2��
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC��CH+HCN��H2C=CH��C��N
��KCNO�и�Ԫ��ԭ�ӵĵ�һ��������С��������Ϊ________��
�ڱ�ϩ�棨H2C=CH��C��N��������̼ԭ�ӹ���ӻ�������_______��������������������Ŀ֮��Ϊ_______��
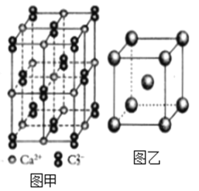
��4��C22����N2��Ϊ�ȵ����壬CaC2����ľ����ṹ��NaCl��������ƣ���ͼ����ʾ������CaC2�����������ε�C22��ʹ������һ������������������ÿ��Ca2+��Χ���������C22����ĿΪ_______��
��5������Fe����CO�γ�Fe(CO)5���û������۵�Ϊ��20�棬�е�Ϊ103�棬�����������_______���塣
��6��ͼ����Fe���ʵľ���ģ�͡���֪�����ܶ�Ϊdg��cm��3����ԭ�ӵİ뾶Ϊ_________nm���ú���d��NA�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1mol����������2mol̼�����ƹ����ϣ����ܱ������У�120���ַ�Ӧ���ų����壬��ȴ���й�����������з�����ȷ���ǣ�������
A.����������2mol Na2CO3
B.���������� Na2CO3��NaOH�Ļ����
C.��Ӧ��ת��2mol����
D.�ų���������1.5mol����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com