
����Ŀ��������ѧ��ѧ����Ԫ��ԭ�ӽṹ�����������ʾ��
��� | Ԫ�� | �ṹ������ |
A | A�����������г������������������Ȼ����Է����������35.5 | |
B | Bԭ���������������ڲ����������1/5 | |
�� | C | C�dz������ʵ���ҪԪ�أ����ʳ����³���̬ |
�� | D | D���ʱ���Ϊ����Ϣ�����Ĵ��������dz��õİ뵼����� |
�� | E | ͨ������£�Eû�������ϼۣ�A��B��C��D��F������E�γɻ����� |
�� | F | F�����ڱ��п������ڢ�A�壬Ҳ����������ڢ�A�� |
(1)AԪ�������ڱ��е�λ��Ϊ____________________________________________��
(2)B��C�γɵĻ�����Ļ�ѧʽΪ________��������________(��������������������)�����
(3)��F��E�����γ�ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1�����ֻ�����X��Y������X��Y��ˮ��Һ��ʵ�鷽����____________________
��F��C��ɵ����ֻ�����M��N�����ĵ������ֱ���X��Y��ȣ���M��ˮ��Һ��________�ԣ�N�ĽṹʽΪ________��
(4)C��E���ǽϻ��õķǽ���Ԫ�أ��û�ѧ����ʽ���������ֵ��ʵ�������ǿ��____��
(5)������ΪB��D�ĵ����õ������Ӻ�����Ȼ�����Һ�п����γ�ԭ��أ�����Ϊ�Ƿ���ԣ������ԣ���д�������ĵ缫����ʽ(����Ϊ���пɲ�д)___________________
���𰸡��������ڵڢ��� Mg3N2 ���� �ֱ�ȡX��Y�����������Թ��У��ٸ�����������MnO2��ĩ��Ѹ�ٲ�����ɫ�������H2O2���������������H2O ������ ![]() 4NH3+3O2
4NH3+3O2![]() 2N2+6H2O Si��4e��+6OH���TSiO32��+3H2O
2N2+6H2O Si��4e��+6OH���TSiO32��+3H2O
��������
A�����������г������������������Ȼ����Է����������35.5����AΪFeԪ�أ�BԪ��ԭ���������������ڲ����������![]() ��B��3�����Ӳ㣬����������Ϊ2����BΪMgԪ�أ�C�dz������ʵ���ҪԪ�أ����ʳ����³���̬��CΪNԪ�أ�D���ʱ���Ϊ����Ϣ�����Ĵ��������dz��õİ뵼����ϣ���DΪSi��F�����ڱ��п������ڢ�A�壬Ҳ����������ڢ�A�壬�仯�ϼ۱���+1����1����FΪHԪ�أ�ͨ������£�Eû����������ϼۣ�A��B��C��D��F������E�γɻ������EΪOԪ�أ��ݴ˽��
��B��3�����Ӳ㣬����������Ϊ2����BΪMgԪ�أ�C�dz������ʵ���ҪԪ�أ����ʳ����³���̬��CΪNԪ�أ�D���ʱ���Ϊ����Ϣ�����Ĵ��������dz��õİ뵼����ϣ���DΪSi��F�����ڱ��п������ڢ�A�壬Ҳ����������ڢ�A�壬�仯�ϼ۱���+1����1����FΪHԪ�أ�ͨ������£�Eû����������ϼۣ�A��B��C��D��F������E�γɻ������EΪOԪ�أ��ݴ˽��
A�����������г������������������Ȼ����Է����������35.5����AΪFeԪ�أ�BԪ��ԭ���������������ڲ����������![]() ��B��3�����Ӳ㣬����������Ϊ2����BΪMgԪ�أ�C�dz������ʵ���ҪԪ�أ����ʳ����³���̬��CΪNԪ�أ�D���ʱ���Ϊ����Ϣ�����Ĵ��������dz��õİ뵼����ϣ���DΪSi��F�����ڱ��п������ڢ�A�壬Ҳ����������ڢ�A�壬�仯�ϼ۱���+1����1����FΪHԪ�أ�ͨ������£�Eû����������ϼۣ�A��B��C��D��F������E�γɻ������EΪOԪ�أ�
��B��3�����Ӳ㣬����������Ϊ2����BΪMgԪ�أ�C�dz������ʵ���ҪԪ�أ����ʳ����³���̬��CΪNԪ�أ�D���ʱ���Ϊ����Ϣ�����Ĵ��������dz��õİ뵼����ϣ���DΪSi��F�����ڱ��п������ڢ�A�壬Ҳ����������ڢ�A�壬�仯�ϼ۱���+1����1����FΪHԪ�أ�ͨ������£�Eû����������ϼۣ�A��B��C��D��F������E�γɻ������EΪOԪ�أ�
(1)AΪFeԪ�أ������ڱ��е�λ��Ϊ���������ڵڢ��壻
(2)Mg��NԪ���γɵĻ�����Ļ�ѧʽΪMg3N2�����������ӻ����
(3)��H��OԪ�ؿ����γ�ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1�����ֻ�����X��Y����XΪH2O��YΪH2O2������X��Y��ˮ��Һ��ʵ�鷽���ǣ��ֱ�ȡX��Y�����������Թ��У��ٸ�����������MnO2��ĩ��Ѹ�ٲ�����ɫ�������H2O2���������������H2O��
��H��N��ɵ����ֻ�����M��N�����ĵ������ֱ���H2O��H2O2��ȣ���MΪNH3��NΪN2H4��NH3���ӹ���Ϊ�����Σ�N2H4�ĽṹʽΪ![]() ��
��
(4)�����������������Դ�����������������ԣ�����˵������������ǿ��������������������������ǿ���ķ���ʽΪ��4NH3+3O2![]() 2N2+6H2O��
2N2+6H2O��
(5)Mg��Si�ĵ����õ������Ӻ����NaOH��Һ�У�Si���������Ʒ�Ӧ���ɹ������������������γ�ԭ��أ�Si����������Ӧ���ʸ�����Siʧȥ���ӣ��������������ɹ������ˮ�������缫��ӦʽΪ��Si��4e��+6OH���TSiO32��+3H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��仯�����ڻ������ɵ�����Ӧ�ù㷺��
��1����ҵβ���е�SO2һֱ�ǻ�����Ⱦ����Ҫԭ��֮һ����ҵ�ϳ��������·�������β���еĺ�������
�ٷ���1��ȼú�м�����ʯ�ң���SO2ת��ΪCaSO3��������ΪCaSO4
��֪��a. CaO(s)+CO(g) =CaCO3(s) ��H=-178.3kJ��mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ��H=-2762.2kJ��mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ��H=-2314.8kJ��mol-1
д��CaO(s)��SO2(g)��Ӧ����CaSO3(s)���Ȼ�ѧ����ʽ��_________________________________��
�ڷ���2���ð�ˮ��SO2ת��ΪNH4HSO3��������Ϊ( NH4)2SO4��
ʵ����NH4HSO3��Һ��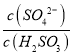 = 1500������Һ��pHΪ______________����֪��H2SO3��Ka1=1.5��10-2��Ka2=1.0��10-7����
= 1500������Һ��pHΪ______________����֪��H2SO3��Ka1=1.5��10-2��Ka2=1.0��10-7����
��2��ú�ƵõĻ���ԭ�����к����ʻ���(0=C=S)�������ʿ�ת��ΪH2S����ӦΪCOS(g) +H2(g)![]() H2S (g)+CO(g) ��H>0��
H2S (g)+CO(g) ��H>0��
�ٺ��º��������£��ܱ������з���������Ӧ��������ʵ����˵����Ӧ�ﵽƽ��״̬����__________
(����ĸ)��
a.COS��Ũ�ȱ��ֲ��� b.��ѧƽ�ⳣ�����ٸı�
c.���������ܶȲ��ٸı� d.�γ�2molH-S����ͬʱ�γ�1mol H-H��
��T1��ʱ���ں��ݵ��ܱ������У���������CO��H2S��ϼ��Ȳ��ﵽ����ƽ�⣺H2S(g)+ CO(s) ![]() COS(g)+H2(g)��K=0 25������¶��·�ӦCOS(g)+H2(g)=H2S(g)+ CO(s)��ƽ�ⳣ��K=__________��
COS(g)+H2(g)��K=0 25������¶��·�ӦCOS(g)+H2(g)=H2S(g)+ CO(s)��ƽ�ⳣ��K=__________��
T1��ʱ�����ݻ�Ϊ10 L�ĺ����ܱ������г���1mol COS(g)��1molH2(g)���ﵽƽ��ʱCOS��ת����Ϊ______________________��
��3����������(H2S2O8)��һ��ǿ�������ᣬ��ṹʽΪ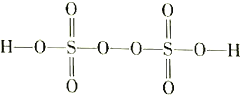 ��
��
����Ag+�������£�S2O82-����Mn2+��ˮ��Һ�з�����Ӧ����SO42-��MnO4-��1mol S2O82-��������Mn2+�����ʵ���Ϊ_________mol��
�ڹ�ҵ�Ͽ��ö��Ե缫������������炙����Һ�Ʊ���������李��������ĵ缫��ӦʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����������ҵ������������ҪӦ�á���ش��������⣺
(1)��ͼ��N2(g)��H2(g)��NH3(g)֮��ת����������ϵͼ����
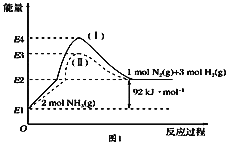
��N2(g)��H2(g)��Ӧ����NH3(g)���Ȼ�ѧ����ʽΪ___________________.
�ڹ���(��)����(��)�ķ�Ӧ��________(���ͬ����ͬ��).
��ij�¶��£���1 L���º��������г���1molN2��3 mol H2����������Ӧ��10 min�ﵽƽ�⣬��ʱ������ѹǿ��Ϊԭ����7/8.
a.�ù��̵�ƽ�ⳣ���ı���ʽΪ____________.
b.N2��ƽ��ת����Ϊ________.
c.��ʱ�����������¶Ⱥ�������䣬�������ټ���2.25 molN2��0.5 mol NH3����ƽ��________(�����������)�ƶ�.
(2)��NH3�������������������Ⱦ����֪��
��Ӧ��4NH3(g)��3O2(g)![]() 2N2(g)��6H2O(g) ��H1��a kJ��mol��1 ƽ�ⳣ��ΪK1
2N2(g)��6H2O(g) ��H1��a kJ��mol��1 ƽ�ⳣ��ΪK1
��Ӧ��N2(g)��O2(g)![]() 2NO(g) ��H2��b kJ��mol��1 ƽ�ⳣ��ΪK2
2NO(g) ��H2��b kJ��mol��1 ƽ�ⳣ��ΪK2
��Ӧ��4NH3(g)��6NO(g)![]() 5N2(g)��6H2O(g) ��H3��c kJ��mol��1 ƽ�ⳣ��ΪK3
5N2(g)��6H2O(g) ��H3��c kJ��mol��1 ƽ�ⳣ��ΪK3
��Ӧ���е�b��_____(�ú�a��c�Ĵ���ʽ��ʾ)��K3=_____(��K1��K2��ʾ).��Ӧ���еĦ�S______(�>����<������)0.
(3)�ں��ݵ��ܱ����У�����һ������NH3��NO����������Ӧ��ò�ͬ�¶��·�Ӧ��ϵ��NH3��ת����(��)��ѹǿp�Ĺ�ϵ��ͼ��ʾ��
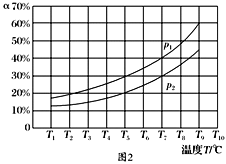
�ٷ�����p1________p2.(�>����<������)
�����������У�������Ϊ�жϷ�Ӧ���Ѿ��ﵽƽ��״̬�ı�־����________(�����).
a��N2��Ũ�Ȳ��ٸı� b������6 mol N��H����ͬʱ����6 mol H��O���γ�
c��������ѹǿ���ٱ仯 d�����������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��ȷ����(�� ��)
A.����˿�����缫����ⱥ��ʳ��ˮ��2Cl��+2H2O![]() 2OH��+Cl2��+H2��
2OH��+Cl2��+H2��
B.Ba(OH)2��Һ�м��������Al2(SO4)3��Һ��3Ba2����6OH����2Al3����3SO42-��3BaSO4����2Al(OH)3��
C.��H218O��Ͷ��Na2O2���壺 2H218O + 2Na2O2�� 4Na+ + 4OH��+ 18O2��
D.ʯ������Ca(OH)2�ĵ��룺Ca(OH)2(s) ![]() Ca2��+ 2OH��
Ca2��+ 2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����������Ƕ�Ӧ���ʵ��۵㣨�棩
NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
�ݴ������������ж��У��������_____��
A ���Ļ����ᄃ���в��������Ӿ���
B ����ֻ��BCl3���ɱ��Ƿ��Ӿ���
C ͬ��Ԫ�ص���������γɲ�ͬ���͵ľ���
D ��ͬ��Ԫ�ص���������γɲ�ͬ���͵ľ���
��2��SiO2����ṹƬ����ͼ��ʾ��SiO2������Siԭ����Ŀ��Si��O����Ŀ�ı���Ϊ_____��
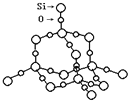
ͨ�����ǰѲ�1mol ij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ�
��ѧ�� | Si-O | Si-Si | O=O |
����/KJmol-1 | 460 | 176 | 498 |
Si(s)+ O2(g)=SiO2(s)���÷�Ӧ�ķ�Ӧ�ȡ�H=__________��
��3�����������徧��������ͼ����ʾ��������ԭ�ӵ���λ��Ϊ_____�������д������ֿ�϶���ֱ���___________��___________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ���ѽ�õ�����ϩ��1��3-����ϩΪԭ�ϣ��������з�Ӧ�ϳɸ߷��ӻ�����H�������ʿ����������Բ�����άΪ���ϵ���ǿ���ϣ��׳Ʋ����֣�
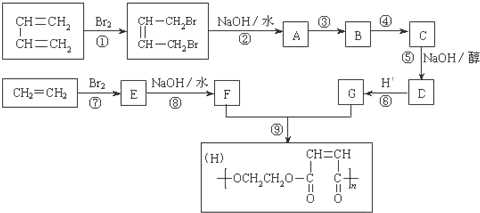
�밴Ҫ����գ�
��1��д�����з�Ӧ�ķ�Ӧ���ͣ���Ӧ�� ___________ �� ��Ӧ�� ___________ ��
��2����Ӧ�ڵĻ�ѧ����ʽ�ǣ�__________ ��
��3����Ӧ�ۡ�������һ��Ӧ����HCl�ӳɣ��÷�Ӧ��______���Ӧ��ţ��������һ����Ӧ��Ŀ����_____������C�Ľṹ��ʽ��_____��
��4��д����G������ͬ�������Ŀ�Ĺ����ŵ�ͬ���칹�壺________��
��5��д���ɼױ��ϳɱ���ȩ�ĺϳ�·��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ã���NH3����Դ����ʵ�ֵ绯ѧ�⻯��Ӧ������˵���������

A.a����
B.b�缫��ӦΪ��2NH3-6e-=N2+6H+
C.���һ��ʱ���װ����H+��Ŀ����
D.������ÿ����1 mol NH3��������1��5mol![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�������γɶ����������Ѫ��[K4Fe(CN)6]����³ʿ����Ѫ���ص�
��1����֪��3K4Fe(CN)6]=2KCN + Fe3C + 3C + (CN)2�� +2N2��
��(CN)2��������������������Ŀ��Ϊn(��)�sn(��)=____��
��(CN)2��һ���������⻯���Եõ��Ҷ�����H2NCH2CH2NH2�����Ҷ���������ˮ������Ϊ�Ǽ��Է����⣬�����ܵ�ԭ����____��
��2����³ʿ���Ļ�ѧʽΪFe4[Fe(CN)6]3��д��������ӻ�̬��������Ų�ʽ____��
��3��Ѫ���أ���ͼ����Ѫ�쵰�ĺϳ�ԭ��֮һ��Ѫ��ɫ�е�Nԭ�ӵ��ӻ�����Ϊ____�����á�������ͼ�б��Fe2+����λ��_________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E���ֶ���������Ԫ�أ����ǵ�ԭ������������������B�ǵؿ��к�������Ԫ�ء���֪A��C��B��D�ֱ���ͬ����Ԫ�أ���B��D��Ԫ��ԭ�Ӻ���������֮����A��C��Ԫ��ԭ�Ӻ���������֮�͵�2�����ڴ���ͬ���ڵ�C��D��E����Ԫ���У�E��ԭ�Ӱ뾶��С��ͨ������£�����Ԫ�صĵ��������������壬���ֹ��塣
��1��AΪ______����Ԫ�ط��ţ���ͬ����BΪ______��CΪ______��D��ԭ�ӽṹʾ��ͼΪ______��
��2���ԱȽ�D��E��Ԫ�ص�����������Ӧˮ���������ǿ����______![]() ______���ѧʽ����
______���ѧʽ����
��3��A��B���γ�ԭ�Ӹ�����Ϊ![]() �Ļ�����仯ѧʽΪ______��
�Ļ�����仯ѧʽΪ______��
��4����E�ĵ���ͨ��A��B��C����Ԫ����ɵĻ������ˮ��Һ�У���д���÷�Ӧ�Ļ�ѧ����ʽ��____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com