
【题目】(1)下列数据是对应物质的熔点(℃)
NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
据此作出的下列判断中,错误的是_____。
A 铝的化合物晶体中不存在离子晶体
B 表中只有BCl3、干冰是分子晶体
C 同族元素的氧化物可形成不同类型的晶体
D 不同族元素的氧化物可形成不同类型的晶体
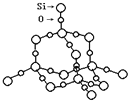
(2)SiO2晶体结构片断如图所示。SiO2晶体中Si原子数目和Si﹣O键数目的比例为_____。
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。
化学键 | Si-O | Si-Si | O=O |
键能/KJmol-1 | 460 | 176 | 498 |
Si(s)+ O2(g)=SiO2(s),该反应的反应热△H=__________。
(3)单质铝晶体晶胞特征如图乙所示.则晶胞中铝原子的配位数为_____,晶胞中存在两种空隙,分别是___________、___________。

【答案】AB 1:4 -990 kJ/mol 12 正四面体空隙 正八面体空隙
【解析】
(1)A.由表中数据可知,AlF3、Al2O3为离子晶体,故A错误;
B.表中AlCl3、BCl3和干冰是分子晶体,沸点都较低,故B错误;
C.C和Si同主族,但氧化物的晶体类型不同,分别属于分子晶体和原子晶体,故C正确;
D.Na和Si不同主族,Na2O属于离子晶体,SiO2属于原子晶体,不同族元素的氧化物可形成不同类型的晶体,故D正确;
故答案为:AB;
(2) SiO2晶体中每个Si原子形成4个Si-O键,1mol SiO2晶体中含有4molSi-O键,则SiO2晶体中Si和Si-O键的比例为1:4,因晶体硅中每个Si原子与周围的4个硅原子形成正四面体,向空间延伸的立体网状结构,每Si原子与周围的4个Si原子形成4个Si-Si键,每个Si-Si键为1个Si原子提供![]() 个Si-Si键,所以1mol晶体硅中含有1mol×4×
个Si-Si键,所以1mol晶体硅中含有1mol×4×![]() =2molSi-Si键,反应热△H=反应物总键能-生成物总键能,所以Si(s)+O2(g)=SiO2(s)中,△H=176kJ/mol×2mol+498kJ/mol-460kJ/mol×4=-990 kJ/mol;
=2molSi-Si键,反应热△H=反应物总键能-生成物总键能,所以Si(s)+O2(g)=SiO2(s)中,△H=176kJ/mol×2mol+498kJ/mol-460kJ/mol×4=-990 kJ/mol;
(3)晶胞中距离最近的原子为位于定点和面心位置的两个原子,每个定点周围有3×![]() ×8=12个原子,即配位数为12;观察晶胞结构可知晶胞中存在两种空隙,分别是正四面体空隙、正八面体空隙。
×8=12个原子,即配位数为12;观察晶胞结构可知晶胞中存在两种空隙,分别是正四面体空隙、正八面体空隙。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对已达化学平衡的反应:2X(g)+Y(g)![]() 2Z(g),减小压强后,对反应产生的影响是
2Z(g),减小压强后,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正反应速率先减小后增大,逆反应速率减小,平衡向逆反应方向移动
D.逆反应速率先减小后增大,正反应速率减小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O,根据题意完成下列填空:
(1) 在上述反应的反应物和生成物中,属于非极性分子的电子式______,属于弱酸的电离方程式______。
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是______(选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为______。
(4) Na2CO3俗称纯碱,属于______晶体。工业上制取纯碱的原料是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钛广泛用于耐高温、耐磨损及航空航天等领域。一种氮化钛的制备反应为:6TiCl4+8NH3=6TiN+24HCl+N2,回答下列问题:
(1)钛在元素周期表中的位置为_____________,基态Ti原子价层电子的轨道表达式为________。
(2)氮可与其他元素形成正离子,如NH4Cl中的NH4+,N2O5中的NO2+。组成这两种正离子的元素中第一电离能由小到大的顺序为____________;NH4+的空间构型为___________;NO2+中氮原子的杂化形式为_______,其中σ键与π键的数目比为_________。
(3)四氯化钛晶体的熔点为-23℃,沸点为136℃,则TiCl4晶体的类型为___________,该晶体中微粒之间的作用力为___________。
(4)一种TiN金黄色晶体晶胞结构与NaCl相同(如图),该晶胞中N原子数目为_______;该氮化钛的密度为5.4g/cm3,则其晶胞参数a=___________pm(用NA表示阿伏加德常数的数值,只列算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1Q > 0(I)
NaNO3(s)+ClNO(g) K1Q > 0(I)
2NO(g)+Cl2(g)![]() 2ClNO(g)K2 Q > 0 (II)
2ClNO(g)K2 Q > 0 (II)
(1)由(I)(II)得到:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)式子,请写出平衡常数表达式K=__________________。
2NaNO3(s)+2NO(g)+Cl2(g)式子,请写出平衡常数表达式K=__________________。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向 2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内V(ClNO)=7.5×10-3molL-1min-1,则平衡后n(Cl2)=_____________ mol,NO的转化率а1=____________。30.其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2____________а1(填“>”“<”或“=”),平衡常数K2____________(填“增大”“减小”或“不变”)。
(3)若要使K2减小,可采用的措施是_________。
(4)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得 1L溶液A,溶液B为0.1molL1的CH3COONa溶液,则两溶液中c(NO3)、c(NO2)和c(CH3COO)由大到小的顺序为___________。(已知HNO2的电离常数Ki=7.1×10-4molL1,CH3COOH的电离常数K i=1.7×10-5molL1)。
(5)可使溶液A和溶液B的pH相等的方法是__________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d..向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素原子结构及性质如表所示:
序号 | 元素 | 结构及性质 |
A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 | |
B | B原子最外层电子数是内层电子总数的1/5 | |
③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
① | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
② | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A元素在周期表中的位置为____________________________________________。
(2)B与C形成的化合物的化学式为________,它属于________(填“离子”或“共价”)化合物。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是____________________
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________性,N的结构式为________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱____。
(5)有人认为B、D的单质用导线连接后插入氯化钠溶液中可以形成原电池,你认为是否可以,若可以,试写出正极的电极方程式(若认为不行可不写)___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钽是一种过渡金属,钽酸锂(LiTaO3)可用于制作滤波器。一种制备钽酸锂的流程如下:回答下列问题:

(1)LiTaO3中钽的化合价为___。
(2)同体A呈红色,其主要成分是___(写化学式),常见用途有___(填一种即可)。
(3)操作2的名称是___,用来检验溶液B中阴离子的常用试剂是___。
(4)HTaO3是___(填字母)。
a.难溶的强酸 b.可溶的弱酸 c.可溶的强酸 d.难溶的弱酸
(5)烧渣与NaOH溶液转化成溶液A的过程中,发生反应的离子方程式为___。
(6)上述废料中含Ta2O5的质量分数为44.2%,杂质不含Ta元素。现有100kg该废料,按上述流程最多可制备___kgLiTaO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组将SO2通入Na2S和Na2SO3的混合溶液中制备硫代硫酸钠(Na2S2O3)。其装置如下图所示(省略夹持装置),下列说法错误的是
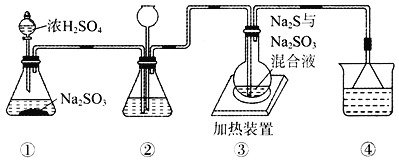
A. 装置②的作用之一是观察SO2的生成速率,其中的液体可以是饱和NaHSO3溶液
B. 为提高产品纯度,使烧瓶中Na2S和Na2SO3恰好完全反应,则![]()
C. 装置④的作用是吸收尾气,同时防止倒吸
D. 装置①也可用于高锰酸钾与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是

A. 五种元素中,原子半径最大的是W
B. Y与Z形成的化合物都可以和盐酸反应
C. 简单阴离子的还原性:Y>W
D. Z与Q形成的化合物水溶液一定显酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com