
【题目】X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是

A. 五种元素中,原子半径最大的是W
B. Y与Z形成的化合物都可以和盐酸反应
C. 简单阴离子的还原性:Y>W
D. Z与Q形成的化合物水溶液一定显酸性
科目:高中化学 来源: 题型:
【题目】(1)下列数据是对应物质的熔点(℃)
NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
据此作出的下列判断中,错误的是_____。
A 铝的化合物晶体中不存在离子晶体
B 表中只有BCl3、干冰是分子晶体
C 同族元素的氧化物可形成不同类型的晶体
D 不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图所示。SiO2晶体中Si原子数目和Si﹣O键数目的比例为_____。
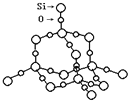
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。
化学键 | Si-O | Si-Si | O=O |
键能/KJmol-1 | 460 | 176 | 498 |
Si(s)+ O2(g)=SiO2(s),该反应的反应热△H=__________。
(3)单质铝晶体晶胞特征如图乙所示.则晶胞中铝原子的配位数为_____,晶胞中存在两种空隙,分别是___________、___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生MnOOH。废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。
Ⅰ.回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液。
步骤二:处理滤液,得到ZnCl2·xH2O晶体。
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)的装置如图:
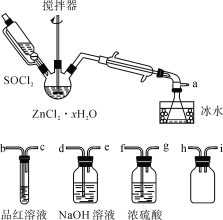
(已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈反应生成两种气体。)
(1)写出SOCl2与水反应的化学方程式:__。
(2)接口的连接顺序为a→__→__→h→i→__→__→__→e。
Ⅱ.回收锰元素,制备MnO2
(3)洗涤步骤一得到的固体,判断固体洗涤干净的方法:__。
(4)洗涤后的固体经初步蒸干后进行灼烧,灼烧的目的:__。
Ⅲ.二氧化锰纯度的测定
称取1.40g灼烧后的产品,加入2.68g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻线,从中取出20.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为17.30mL。
(5)写出MnO2溶解反应的离子方程式__。
(6)产品的纯度为__。
(7)若灼烧不充分,滴定时消耗高锰酸钾溶液体积__(填“偏大”“偏小”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
A.浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸
B.通过改变温度和浓度等条件,利用平衡移动原理制取HCl
C.两种强酸混合,溶解度会相互影响,低溶解度的物质析出
D.浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气脱硝技术是烟气治理的发展方向和研究热点。
(1)用NH3选择性脱除氮氧化物,有如下反应:
6NO(g)+4NH3(g)=5N2(g)+6H2O(g)
已知化学键的键能数据如下表:
化学键 | NO中的氮氧键 | N-H | N | O-H |
键能(kJ·mol-1) | a | b | c | d |
则该反应的ΔH=__kJ·mol-1。
(2)在汽车尾气的净化装置中CO和NO发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
实验测得:v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)
①达平衡后,仅升高温度,k正增大的倍数__k逆增大的倍数(填“>”或“<”或“=”)。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡,CO的转化率为50%,则![]() =__。
=__。
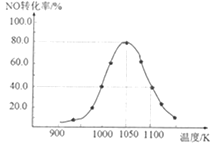
(3)现利用反应除去汽车尾气中的NOx:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
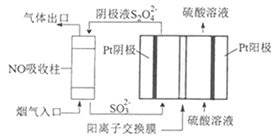
①阴极区的电极反应式为__。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为__mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常情况下,五种元素的单质中有三种气体,两种固体。
(1)A为______(填元素符号,下同),B为______,C为______;D的原子结构示意图为______。
(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱:______![]() ______(填化学式)。
______(填化学式)。
(3)A和B可形成原子个数比为![]() 的化合物,其化学式为______。
的化合物,其化学式为______。
(4)将E的单质通入A、B、C三种元素组成的化合物的水溶液中,试写出该反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在150℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,下列各组混合烃中符合此条件的是( )
A.CH4 和C2H4B.CH4 和C3H6C.C2H2 和C3H4D.C2H2 和C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+* H)。下列说法错误的是
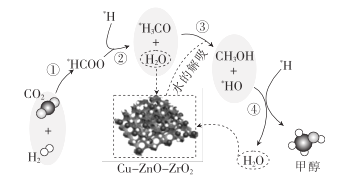
A.向该反应体系中加入少量的水能增加甲醇的收率
B.带*标记的物质是该反应历程中的中间产物
C.二氧化碳加氢制甲醇的过程中原子利用率达100%
D.第③步的反应式为*H3CO+ H2O→CH3OH+*HO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com