
【题目】实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
A.浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸
B.通过改变温度和浓度等条件,利用平衡移动原理制取HCl
C.两种强酸混合,溶解度会相互影响,低溶解度的物质析出
D.浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸
科目:高中化学 来源: 题型:
【题目】氮化钛广泛用于耐高温、耐磨损及航空航天等领域。一种氮化钛的制备反应为:6TiCl4+8NH3=6TiN+24HCl+N2,回答下列问题:
(1)钛在元素周期表中的位置为_____________,基态Ti原子价层电子的轨道表达式为________。
(2)氮可与其他元素形成正离子,如NH4Cl中的NH4+,N2O5中的NO2+。组成这两种正离子的元素中第一电离能由小到大的顺序为____________;NH4+的空间构型为___________;NO2+中氮原子的杂化形式为_______,其中σ键与π键的数目比为_________。
(3)四氯化钛晶体的熔点为-23℃,沸点为136℃,则TiCl4晶体的类型为___________,该晶体中微粒之间的作用力为___________。
(4)一种TiN金黄色晶体晶胞结构与NaCl相同(如图),该晶胞中N原子数目为_______;该氮化钛的密度为5.4g/cm3,则其晶胞参数a=___________pm(用NA表示阿伏加德常数的数值,只列算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组将SO2通入Na2S和Na2SO3的混合溶液中制备硫代硫酸钠(Na2S2O3)。其装置如下图所示(省略夹持装置),下列说法错误的是
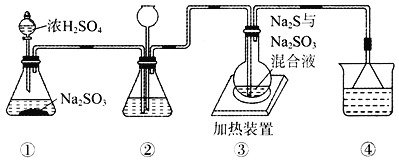
A. 装置②的作用之一是观察SO2的生成速率,其中的液体可以是饱和NaHSO3溶液
B. 为提高产品纯度,使烧瓶中Na2S和Na2SO3恰好完全反应,则![]()
C. 装置④的作用是吸收尾气,同时防止倒吸
D. 装置①也可用于高锰酸钾与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
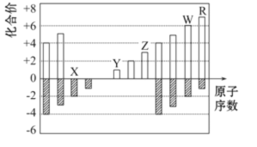
A.原子半径:Z>Y>X
B.气态氢化物稳定性:R<W
C.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2g 。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、胶头滴管、药匙和__________________、_________________。
(2)写出Na2SO3固体氧化变质的化学方程式__________________________________。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,目的是_____________________________,在过滤前,需要检验是否沉淀完全,其操作是___________________________。
(4)方案I中,若滤液浑浊,将导致测定结果____________(选填“偏高”或“偏低”)。
(5)若操作正确,则m1_____ m2(选填“>”、“<”或“=”),原因是________________。
(6)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是________。
a.酸性KMnO4溶液 b.H2O2溶液 c.Br2水 d.FeCl3溶液
Na2SO3固体的纯度可表示为:______________________________(注明你的表达式中所用的有关符号的含义和单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol过氧化钠与2mol碳酸氢钠固体混合,在密闭容器中,120℃充分反应后,排出气体,冷却,有固体残留.下列分析正确的是( )
A.残留固体是2mol Na2CO3
B.残留固体是 Na2CO3和NaOH的混合物
C.反应中转移2mol电子
D.排出的气体是1.5mol氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是

A. 五种元素中,原子半径最大的是W
B. Y与Z形成的化合物都可以和盐酸反应
C. 简单阴离子的还原性:Y>W
D. Z与Q形成的化合物水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出了五种元素的相关信息,其中![]() 、
、![]() 、
、![]() 、
、![]() 为短周期元素。
为短周期元素。
元素 | 相关信息 |
| 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| 工业上通过分离液态空气获得它的一种单质,含它的另一种单质的浓度相对较高的平流层是保护地球地表环境的重要屏障 |
| 植物生长所需的主要元素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| 室温下其单质为粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| 它是人体不可缺少的微量元素,含该元素的合金是工业生产中不可缺少的金属材料,常用于建造桥梁、楼房等 |
根据上述信息填空:
(1)![]() 元素的原子含有________个能层,其中第二能层中的能级包括_________;画出
元素的原子含有________个能层,其中第二能层中的能级包括_________;画出![]() 的原子结构示意图:________________。
的原子结构示意图:________________。
(2)![]() 与
与![]() 形成的某种化合物能和
形成的某种化合物能和![]() 与
与![]() 形成的另一种无色化合物(这两种化合物分子中
形成的另一种无色化合物(这两种化合物分子中![]() 与另一元素原子的个数比均为
与另一元素原子的个数比均为![]() )一起用作火箭推进剂,写出二者发生反应生成无毒物质的化学方程式:__________________________________。
)一起用作火箭推进剂,写出二者发生反应生成无毒物质的化学方程式:__________________________________。
(3)某矿藏主要含![]() 、
、![]() 两种元素组成的化合物,它是我国生产某强酸的主要原料。试写出生产该强酸过程中第一阶段主要反应的化学方程式:________。
两种元素组成的化合物,它是我国生产某强酸的主要原料。试写出生产该强酸过程中第一阶段主要反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学反应原理,解决以下问题:
(1)KAl(SO4)2·12H2O可做净水剂,其原理是_________(用离子方程式表示)
(2)向FeCl3溶液中滴加NaHCO3溶液,有沉淀和气体生成的离子方程式_________________。
(3)室温下将0.12 mol/L HCl溶液与0.1 mol/L NaOH溶液等体积混合,混合液的pH=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com