
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1Q > 0(I)
NaNO3(s)+ClNO(g) K1Q > 0(I)
2NO(g)+Cl2(g)![]() 2ClNO(g)K2 Q > 0 (II)
2ClNO(g)K2 Q > 0 (II)
(1)由(I)(II)得到:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)式子,请写出平衡常数表达式K=__________________。
2NaNO3(s)+2NO(g)+Cl2(g)式子,请写出平衡常数表达式K=__________________。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向 2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内V(ClNO)=7.5×10-3molL-1min-1,则平衡后n(Cl2)=_____________ mol,NO的转化率а1=____________。30.其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2____________а1(填“>”“<”或“=”),平衡常数K2____________(填“增大”“减小”或“不变”)。
(3)若要使K2减小,可采用的措施是_________。
(4)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得 1L溶液A,溶液B为0.1molL1的CH3COONa溶液,则两溶液中c(NO3)、c(NO2)和c(CH3COO)由大到小的顺序为___________。(已知HNO2的电离常数Ki=7.1×10-4molL1,CH3COOH的电离常数K i=1.7×10-5molL1)。
(5)可使溶液A和溶液B的pH相等的方法是__________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d..向溶液B中加适量NaOH
【答案】K=[NO]2[Cl2]/[NO2]4 2.5×10-2 75% > 不变 升高温度 c(NO3) > c(NO2) > c(CH3COO) b、c
【解析】
(1)依据化学平衡常数概念,结合反应化学方程式书写平衡常数;
(2)依据平衡三段式列式计算,依据速率概念、转化率概念的计算;
(3)平衡常数随温度变化;
(4﹣5)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液中NaNO3物质的量浓度为0.mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1molL﹣1的CH3COONa溶液,已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1,说明CH3COOH酸性小于HNO2的酸性,对应阴离子水解程度大,据此分析判断。
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=![]() ;
;
(2)在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1,物质的量为7.5×10﹣3molL﹣1min﹣1×10min×2L=0.15mol,

则平衡后n(Cl2)=0.025mol,NO的转化率α1=![]() ×100%=75%;其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2 增大;平衡常数随温度变化,不随浓度、压强变化,所以平衡常数K2不变;
×100%=75%;其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2 增大;平衡常数随温度变化,不随浓度、压强变化,所以平衡常数K2不变;
(3)若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行;
(4)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1molL﹣1的CH3COONa溶液,已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1,说明CH3COOH酸性小于HNO2的酸性,对应阴离子水解程度大,醋酸根离子和亚硝酸根离子水解,两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为:c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣);
(5)使溶液A和溶液B的pH值相等的方法,依据溶液组成和性质分析,溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1molL﹣1的CH3COONa溶液,溶液B碱性大于A溶液;
a.上述分析可知,溶液B碱性大于A溶液,向溶液A中加适量水,稀释溶液,碱性减小,不能调节溶液pH相同,故a不符合;
b.向溶液A中加适量NaOH,增大碱性,可以调节溶液pH相同,故b符合;
c.向溶液B中加适量水,稀释溶液碱性减弱,可以调节溶液pH,故c符合;
d.溶液B碱性大于A溶液,向溶液B中加适量NaOH,溶液PH更大,不能调节溶液pH相同,故d不符合;
故答案为:bc。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
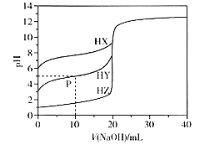
A.电离常数Ka(HX)的数量级为10-12
B.P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C.pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D.HX的电离程度大于X-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:xA(气)+yB(气)![]() zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
A. x+y<z B. 平衡向右移动
C. B的转化率升高 D. C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3, | 溶液呈红色 | 稀HNO3将Fe氧化为 |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与SCN-形成的配离子颜色极似血液,常被用于电影特技和魔术表演。回答下列问题:
(1)写出Fe3+的电子排布式:___________;SCN-的结构式为________
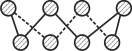
(2)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为______。S8易溶于二硫化碳的原因是__________________________________________________。
(3)已知立方氮化硼晶体内存在配位键,则其晶体中配位键与普通共价键数目之比为______。原子坐标参数可表示晶胞内部各原子的相对位置,图中a处B的原子坐标参数为(0, 0, 0),则距离该B原子最近的N原子坐标参数为_________。
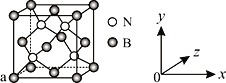
(4)单质铁的晶体结构如图所示,该堆积方式名称为________。已知该晶胞的密度为ρ g/cm3,则铁原子半径的计算式为______________ pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列数据是对应物质的熔点(℃)
NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
据此作出的下列判断中,错误的是_____。
A 铝的化合物晶体中不存在离子晶体
B 表中只有BCl3、干冰是分子晶体
C 同族元素的氧化物可形成不同类型的晶体
D 不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图所示。SiO2晶体中Si原子数目和Si﹣O键数目的比例为_____。
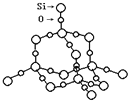
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。
化学键 | Si-O | Si-Si | O=O |
键能/KJmol-1 | 460 | 176 | 498 |
Si(s)+ O2(g)=SiO2(s),该反应的反应热△H=__________。
(3)单质铝晶体晶胞特征如图乙所示.则晶胞中铝原子的配位数为_____,晶胞中存在两种空隙,分别是___________、___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a 减压 b 增加NH3的浓度 c 升温 d 及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式__________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为_________。其中氮元素原子最外层电子排布的轨道表达式是___________。通过比较_____________可判断氧,硫两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是________。CS2熔点高于CO2,其原因是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用Zn和稀硫酸反应制取氢气,向反应液中滴入几滴CuSO4溶液,产生气泡的速率明显加快 | Cu2+是反应的催化剂 |
B | 向滴有酚酞的1mL0.1mol·L-1Na2CO3溶液中加水稀释至10mL,红色变浅 | 加水稀释时,CO32—的水解平衡向逆反应方向移动 |
C | 向5 mL 0.1 mol·L-1 KI溶液中加入0.1 mol·L-1 FeCl3溶液1 mL,振荡,用苯萃取2~3次后,取下层溶液滴加5滴KSCN溶液,出现血红色 | 反应2Fe3++2I-=2Fe2++I2是有一定限度的 |
D | 向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸有气泡产生 | Ksp(BaCO3)<Ksp(BaSO4) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气脱硝技术是烟气治理的发展方向和研究热点。
(1)用NH3选择性脱除氮氧化物,有如下反应:
6NO(g)+4NH3(g)=5N2(g)+6H2O(g)
已知化学键的键能数据如下表:
化学键 | NO中的氮氧键 | N-H | N | O-H |
键能(kJ·mol-1) | a | b | c | d |
则该反应的ΔH=__kJ·mol-1。
(2)在汽车尾气的净化装置中CO和NO发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
实验测得:v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)
①达平衡后,仅升高温度,k正增大的倍数__k逆增大的倍数(填“>”或“<”或“=”)。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡,CO的转化率为50%,则![]() =__。
=__。
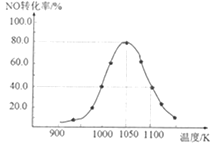
(3)现利用反应除去汽车尾气中的NOx:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
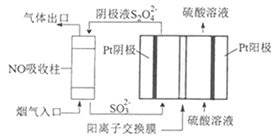
①阴极区的电极反应式为__。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为__mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com