
【题目】Fe3+与SCN-形成的配离子颜色极似血液,常被用于电影特技和魔术表演。回答下列问题:
(1)写出Fe3+的电子排布式:___________;SCN-的结构式为________
(2)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为______。S8易溶于二硫化碳的原因是__________________________________________________。
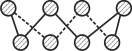
(3)已知立方氮化硼晶体内存在配位键,则其晶体中配位键与普通共价键数目之比为______。原子坐标参数可表示晶胞内部各原子的相对位置,图中a处B的原子坐标参数为(0, 0, 0),则距离该B原子最近的N原子坐标参数为_________。
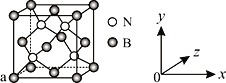
(4)单质铁的晶体结构如图所示,该堆积方式名称为________。已知该晶胞的密度为ρ g/cm3,则铁原子半径的计算式为______________ pm。

【答案】1s22s22p63s23p63d5或[Ar]3d5 [S-C≡N]-或[S=C=N]- 哑铃形 sp3 S8和二硫化碳都是非极性分子,由相似相溶原理S8易溶于二硫化碳 1:3 (![]() ,
,![]() ,
,![]() ) 体心立方堆积
) 体心立方堆积 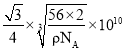
【解析】
(1)Fe3+的外围电子排布为3d5,结合泡利原理、洪特规则画出排布图为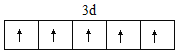 ;SCN-与CO2互为等电子体,二者结构相似,SCN-结构式为[S-C≡N]-或[S=C=N]-,SCN-中σ键与π键数目之比,2:2=1:1;
;SCN-与CO2互为等电子体,二者结构相似,SCN-结构式为[S-C≡N]-或[S=C=N]-,SCN-中σ键与π键数目之比,2:2=1:1;
(2)基态S原子核外电子排布式为1s22s22p63s23p4,其最高能级的电子为3p电子,电子云为哑铃形;S原子形成2个S-S键、还有2对孤电子对,杂化轨道数目为4,为sp3杂化;S8、CS2都是非极性分子,根据相似相溶知,S8易溶于二硫化碳;
(3)硼原子价电子数为3,形成4个共价键,有1个配位键、3个普通化学键;a处B的原子坐标参数为(0,0,0),距离该B原子最近的N原子连线处于晶胞体对角线上,且二者距离为体对角线的![]() ,则该N原子到各坐标平面距离均等于晶胞棱长的
,则该N原子到各坐标平面距离均等于晶胞棱长的![]() ,故该坐标为(
,故该坐标为(![]() ,
,![]() ,
,![]() );
);
(4)该堆积方式为体心立方堆积,该晶胞中Fe原子个数=1+8×![]() =2,体对角线上3个原子紧密相邻,晶胞棱长=
=2,体对角线上3个原子紧密相邻,晶胞棱长=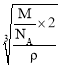 ,体心立方堆积中原子半径=
,体心立方堆积中原子半径=![]() ×棱长,所以铁原子半径=
×棱长,所以铁原子半径= 。
。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有大量PbI2的饱和溶液中存在着平衡PbI2(s)![]() Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
A.平衡逆向移动I-浓度减小B.溶度积常数Ksp减小
C.沉淀溶解平衡不移动D.PbI2的溶解度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
Ⅰ.探究反应速率的影响因素
设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20mol·L-1H2C2O4溶液、0.010mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
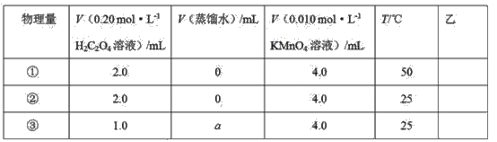
上述实验①、②是探究__对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__;乙是实验需要测量的物理量,则表格中“乙”应填写__。
Ⅱ.测定H2C2O4·xH2O中x值
已知:M(H2C2O4)=90g·mol-1
①称取1.260g纯草酸晶体,将草酸制成100.00mL水溶液为待测液;
②取25.00mL待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05000mol·L-1的KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式___。
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是___(选填a、b)。
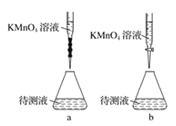
(3)由图可知消耗KMnO4溶液体积为___mL,滴定管内剩余的液体的体积为___。

A.20.9 B.大于20.9 C.小于29.1 D.大于29.1
(4)滴定过程中眼睛应注视___,滴定终点的现象为___。
(5)通过上述数据,求得x=___。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果___(偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图所示装置做实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
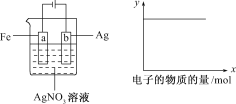
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③B.③④
C.①②④D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1Q > 0(I)
NaNO3(s)+ClNO(g) K1Q > 0(I)
2NO(g)+Cl2(g)![]() 2ClNO(g)K2 Q > 0 (II)
2ClNO(g)K2 Q > 0 (II)
(1)由(I)(II)得到:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)式子,请写出平衡常数表达式K=__________________。
2NaNO3(s)+2NO(g)+Cl2(g)式子,请写出平衡常数表达式K=__________________。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向 2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内V(ClNO)=7.5×10-3molL-1min-1,则平衡后n(Cl2)=_____________ mol,NO的转化率а1=____________。30.其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2____________а1(填“>”“<”或“=”),平衡常数K2____________(填“增大”“减小”或“不变”)。
(3)若要使K2减小,可采用的措施是_________。
(4)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得 1L溶液A,溶液B为0.1molL1的CH3COONa溶液,则两溶液中c(NO3)、c(NO2)和c(CH3COO)由大到小的顺序为___________。(已知HNO2的电离常数Ki=7.1×10-4molL1,CH3COOH的电离常数K i=1.7×10-5molL1)。
(5)可使溶液A和溶液B的pH相等的方法是__________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d..向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较下列各项中的前者和后者,用“>”、 “<”或“=”填空
(1)熔点:NaCl_______CaO
(2)沸点: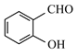 ____
____![]()
(3)在水中的溶解度:SO2_____CO2
(4)酸性:H3PO3_________H3PO4
(5)键能:H—O______ H—S
(6)价电子数:O________Cr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原法处理氮的氧化物是环境科学研究的热点课题。
I.氧气还原法。H2还原NO发生的反应为:2NO(g)+2H2(g)![]() N2(g)+2H2O(g)。
N2(g)+2H2O(g)。
(1)已知儿种化学键的键能数据如下:

2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH=___kJ·mol-1。
N2(g)+2H2O(g) ΔH=___kJ·mol-1。
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
反应1:2NO(g)+H2(g)![]() N2(g)+H2O2(g);
N2(g)+H2O2(g);
反应2:H2O2(g)+H2(g)![]() 2H2O(g)。
2H2O(g)。
总反应速率由反应较慢的一步决定,由此推知上述两步反应中,活化能较大的是反应___(填“l”或“2”)。c(NO)对总反应速率的影响程度___c(H2)(填“大于”“小于”或“等于”)。
Ⅱ.NH3还原法。在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)。
7N2(g)+12H2O(g)。
(3)下列表明该反应达到平衡状态的是___(填字母)。
A.混合气体密度保持不变 B.NO2和N2的消耗速率之比为6:7
C.混合气体中c(N2)=c(NO2) D.混合气体压强保持不变
III.CO还原法。利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
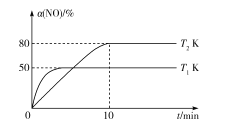
(4)下列说法正确的是___(填字母)。
A.图像中,T1>T2
B.上述反应在高温下能自发进行
C.10min时,T2K下正、逆反应速率相等
D.增大NO的浓度,反应物的转化率增大
(5)T2K温度下,0-10min内用CO表示的平均反应速率v(CO)=___mol/L-1·min-1;T1K温度下,上述反应的平衡常数K=___L·mol-1。
(6)T1K温度下,向平衡后的容器内再加入2molN2和2molNO,则平衡___(填“向右移动”“向左移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上CO2、CH4等含碳化合物有着重要的应用。
(1)科学家以CH4为原料来制备乙烯,同时得到氢气。已知相关物质的标准燃烧热如下表所示,写出甲烷制备乙烯的热化学方程式:__。
物质 | 标准燃烧热/kJ·mol-1 |
氢气 | -285.8 |
甲烷 | -890.3 |
乙烯 | -1411.0 |
(2)在400℃时,向初始体积为1L的恒容密闭反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%。
①该温度下,平衡常数K=__。
②若向该平衡体系中充入等物质的量的CH4和H2,则平衡将___(填“正向移动”或“逆向移动”或“不移动”成“无法确定”),理由是__。
(3)科学家用氮化镓材料与铜组装成如图所示的人工光合系统实现CO2的再利用。
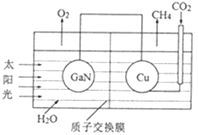
①该电化学装置属于__(填“原电池”或“电解池”)。
②该电池的Cu电极上发生反应的电极方程式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com