
【题目】比较下列各项中的前者和后者,用“>”、 “<”或“=”填空
(1)熔点:NaCl_______CaO
(2)沸点: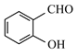 ____
____![]()
(3)在水中的溶解度:SO2_____CO2
(4)酸性:H3PO3_________H3PO4
(5)键能:H—O______ H—S
(6)价电子数:O________Cr
【答案】< < > < > =
【解析】
(1)NaCl中离子所带电荷数为1,CaO中离子所带电荷数为2,且O2-的半径小于Cl-的半径,所以氯化钠的晶格能小于氧化钙的晶格能,所以熔点:NaCl<CaO;
(2)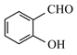 形成分子内氢键,而
形成分子内氢键,而![]() 形成分子间氢键,分子间形成氢键的物质的熔沸点较高,所以沸点:
形成分子间氢键,分子间形成氢键的物质的熔沸点较高,所以沸点: <
<![]() ;
;
(3)SO2分子为V形,结构不对称,属于极性分子,CO2分子为直线形,是非极性分子,水是极性分子,根据相似相溶原理,在水中的溶解度:SO2>CO2;
(4)含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强,所以含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强,则酸性:H3PO3<H3PO4;
(5)同一主族元素,元素原子半径随着原子序数增大而增大,键长:H-O<H-S,所以键能:H-O>H-S;
(6)O的价层电子排布式为2s22p4,价电子个数为6;Cr的价层电子排布式为3d54s1,价电子个数为6,所以价电子数:O=Cr。


科目:高中化学 来源: 题型:
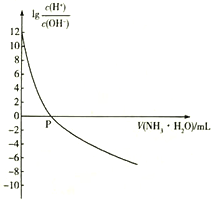
【题目】25℃时,NH4+的水解平衡常数为Kb=5.556×10 -10。该温度下,用0.100 mol·L-1的氨水滴定10.00ml 0.050 mol·L-1的二元酸H2A的溶液,滴定过程中加入氨水的体积(V 与溶液中lg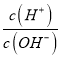 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A. H2A的电离方程式为H2A![]() H++A2-
H++A2-
B. 25℃时,Kb(NH3·H2O)=1.8×10-5
C. P点时加入氨水的体积为10 mL
D. 向H2A溶液中滴加氨水的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B.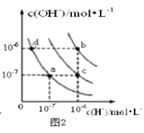 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C.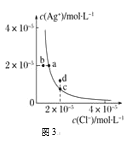 图3中d点没有AgCl沉淀生成
图3中d点没有AgCl沉淀生成
D.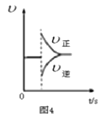 图4表示在N2(g)+3H2(g)
图4表示在N2(g)+3H2(g)![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与SCN-形成的配离子颜色极似血液,常被用于电影特技和魔术表演。回答下列问题:
(1)写出Fe3+的电子排布式:___________;SCN-的结构式为________
(2)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为______。S8易溶于二硫化碳的原因是__________________________________________________。
(3)已知立方氮化硼晶体内存在配位键,则其晶体中配位键与普通共价键数目之比为______。原子坐标参数可表示晶胞内部各原子的相对位置,图中a处B的原子坐标参数为(0, 0, 0),则距离该B原子最近的N原子坐标参数为_________。
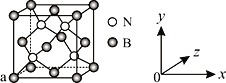
(4)单质铁的晶体结构如图所示,该堆积方式名称为________。已知该晶胞的密度为ρ g/cm3,则铁原子半径的计算式为______________ pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和_____________。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性
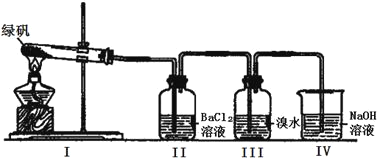
(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是_____________。
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是_______。
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:_________。
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
实验步骤 | 实验预期现象及结论 |
步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |
_________________________ |
步骤二:______________ |
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a 减压 b 增加NH3的浓度 c 升温 d 及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式__________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为_________。其中氮元素原子最外层电子排布的轨道表达式是___________。通过比较_____________可判断氧,硫两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是________。CS2熔点高于CO2,其原因是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
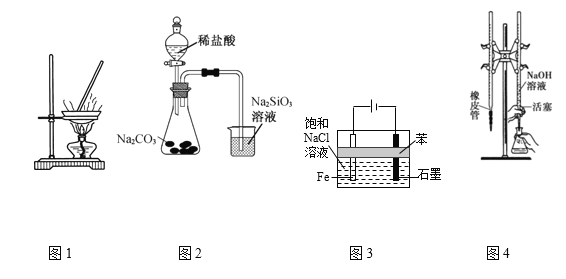
A.用图1装置蒸发CuCl2溶液获得无水CuCl2
B.用图2装置可证明非金属强弱:Cl>C>Si
C.用图3装置制备少量白色的Fe(OH)2沉淀
D.用图4装置进行已知浓度的NaOH溶液测定未知浓度的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以活性炭为催化剂,可以将工业废气中的SO2催化氧化变为硫酸,进而制得各种硫酸盐,如硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]等。
(1)研究表明,SO2在活性炭上催化氧化的反应机理可以表示为(*标记的为吸附状态)
Ⅰ.二氧化硫的吸附:SO2(g)![]() SO2* ΔH1=a kJ·mol-1
SO2* ΔH1=a kJ·mol-1
Ⅱ.氧气的吸附:O2(g)![]() 2O* ΔH2=b kJ·mol-1
2O* ΔH2=b kJ·mol-1
Ⅲ.三氧化硫的氧化:SO2*+O*=SO3* ΔH3=c kJ·mol-1
Ⅳ.三氧化硫的脱附:SO3*![]() SO3(g) ΔH4=d kJ·mol-1
SO3(g) ΔH4=d kJ·mol-1
根据上述反应机理,写出SO2在活性炭上催化氧化的热化学方程式____。
(2)以硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为原料通过下列流程可以制备晶体A。

①已知25 ℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O42-(aq),K=10-16。某研究小组同学欲检验晶体A中含有三价铁,取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1 mol·L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:____。
[Fe(SCN)]2+(aq)+3C2O42-(aq),K=10-16。某研究小组同学欲检验晶体A中含有三价铁,取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1 mol·L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:____。
②某研究小组通过如下实验步骤测定晶体A的化学式:
步骤1:准确称取A样品4.910 0 g,干燥脱水至恒重,残留物质量为4.370 0 g;
步骤2:准确称取A样品4.910 0 g置于锥形瓶中,加入足量的3.000 mol·L-1 H2SO4溶液和适量蒸馏水,用0.500 0 mol·L-1 KMnO4溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为24.00 mL;(C2O42-+MnO4-+H+→CO2↑+Mn2++H2O)
步骤3:将步骤1所得固体溶于水,加入铁粉0.280 0 g,恰好完全反应。
通过计算确定晶体A的化学式(写出计算过程)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素金属性、非金属性的说法正确的是( )
A.![]() 的酸性强于
的酸性强于![]() ,故非金属性:
,故非金属性:![]()
B.第ⅠA族金属元素是同周期中金属性最强的元素
C.仅用![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,无法验证
溶液,无法验证![]() 、
、![]() 的金属性强弱
的金属性强弱
D.第ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com