
【题目】按下图所示装置做实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
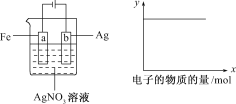
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③B.③④
C.①②④D.①②⑤
【答案】D
【解析】
根据图中装置试验,Fe、Ag、AgNO3构成的电解池,
由图a可知,Ag连接电源的正极,则为阳极,电解质溶液为硝酸银溶液,则该装置实际上是在铁的表面电镀银,电解质溶液的浓度不变,即Ag+、NO3﹣的浓度不变,溶液的浓度及pH不变,图b中,Y轴表示某个量不变,
①阳极Ag溶解Ag﹣e﹣=Ag+,阴极铁上银离子得电子析出金属银Ag++e﹣=Ag,溶液中c(Ag+)不变,故①可选;
②硝酸根离子未参与电极反应,所以c(NO3﹣)不变,故②可选;
③a棒铁棒连接电源的负极为电解池的阴极,银离子得电子析出金属银Ag++e﹣=Ag,所以质量增加,故③不可选;
④b棒Ag连接电源的正极,则为阳极,Ag﹣e﹣=Ag+,质量在减轻,故④不可选;
⑤该反应本质为在铁的表面电镀银,电解质溶液的浓度不变,溶液的pH不变,,故⑤可选;
①②⑤可选,故答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如下图所示。
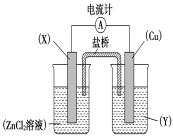
请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是__________________。
(2)铜电极为电池的________极,发生的电极反应为_______________________ X极上发生的电极反应为______________。
(3)外电路中的电子是从________极流向__________极(填名称)。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.24 g金属,则乙池中溶质可能是( )
A.KNO3B.MgSO4C.CuSO4D.Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B.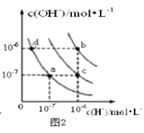 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C.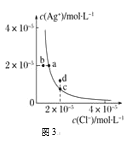 图3中d点没有AgCl沉淀生成
图3中d点没有AgCl沉淀生成
D.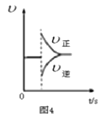 图4表示在N2(g)+3H2(g)
图4表示在N2(g)+3H2(g)![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关微粒的相互关系和特征描述正确的是( )
选项 | 微粒 | 相互关系 | 特征描述 |
A | C60、C70、C540 | 同位素 | 微粒中只含非极性共价键 |
B | 新烷、2,2﹣二甲基丙烷 | 同分异构体 | 常温常压下呈气态 |
C |
| 同素异形体 | 铂作氨催化氧化时的催化剂 |
D | 甲酸、硬脂酸 | 同系物 | 能发生酯化反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与SCN-形成的配离子颜色极似血液,常被用于电影特技和魔术表演。回答下列问题:
(1)写出Fe3+的电子排布式:___________;SCN-的结构式为________
(2)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为______。S8易溶于二硫化碳的原因是__________________________________________________。
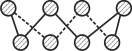
(3)已知立方氮化硼晶体内存在配位键,则其晶体中配位键与普通共价键数目之比为______。原子坐标参数可表示晶胞内部各原子的相对位置,图中a处B的原子坐标参数为(0, 0, 0),则距离该B原子最近的N原子坐标参数为_________。
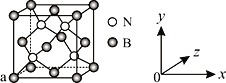
(4)单质铁的晶体结构如图所示,该堆积方式名称为________。已知该晶胞的密度为ρ g/cm3,则铁原子半径的计算式为______________ pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和_____________。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性
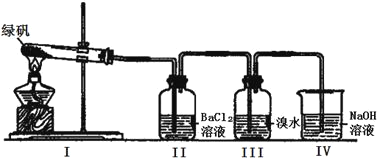
(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是_____________。
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是_______。
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:_________。
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
实验步骤 | 实验预期现象及结论 |
步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |
_________________________ |
步骤二:______________ |
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
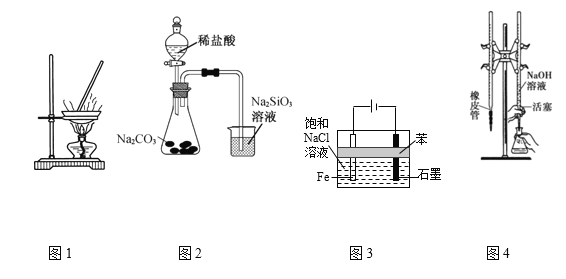
A.用图1装置蒸发CuCl2溶液获得无水CuCl2
B.用图2装置可证明非金属强弱:Cl>C>Si
C.用图3装置制备少量白色的Fe(OH)2沉淀
D.用图4装置进行已知浓度的NaOH溶液测定未知浓度的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
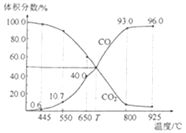
A.550℃时,若充入稀有气体,v正、v逆均减小,平衡不移动
B.T℃时,反应达平衡后CO2的转化率为50%
C.T℃时,若充入等体积的CO2和CO,平衡不移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com