
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
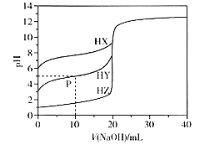
A.电离常数Ka(HX)的数量级为10-12
B.P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C.pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D.HX的电离程度大于X-的水解程度
【答案】B
【解析】
A.起始时HA溶液pH=6,则溶液中c(H+)=c(A-)=10-6mol/L,所以Ka(HA)=![]() =
=![]() =10-11,所以数量级不是10-12,故A错误;
=10-11,所以数量级不是10-12,故A错误;
B.P点为在HY溶液中加入10mLNaOH溶液,溶液中含有等浓度的NaY和HY,溶液显酸性,说明HY的电离程度大于NaY的水解程度,所以c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-),故B正确;
C.pH=7时,根据电荷守恒,溶液中均存在,c(Na+) =c(X-),c(Na+)=c(Y-) ,c(Na+)=c(Z-),三种溶液中加入的NaOH体积不等,即c(Na+)各不相同,所以c(X-)≠c(Y-)≠c(Z-),故C错误;
D.当加入10mLNaOH溶液时,HX溶液中恰好反应生成等量的HX和NaX,此时溶液显碱性,说明X-的水解程度大于HX的电离程度,故D错误;
故选B。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,分子中碳与氢元素的质量比为6:1,,是同系物中最简单的物质。X为有浓郁香味、不易溶于水的油状液体。它们之间的转化关系如图:
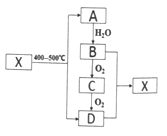
请回答:
(1)有机物D中含有的官能团名称是_________。
(2)A→B的反应类型是_______________。
(3)有机物X在400~500℃下转化为A和D的化学方程式是_____________________。
(4)下列说法正确的是_______________。
A.工业上获得A的的主要方法是催化裂化
B.将绿豆大小的钠投入到B中,钠块浮在液面上,并产生气泡
C.除去C中的D可以先加饱和碳酸钠溶液再蒸馏
D.一定条件下,1molX与足量NaOH溶液反应时,最多消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一包固体粉末,其中可能含有如下五种物质:CaCO3、K2CO3、Na2SO4、NaCl、CuSO4。现进行如下实验:①溶于水得无色溶液,溶液中无沉淀出现;②向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失。根据上述实验现象推断:
(1)一定不存在的物质是_____________________;
(2)写出加入盐酸时沉淀消失的离子反应方程式___________________________;
(3)可能存在的物质是___________;
(4)写出下列物质在水溶液中的电离方程式
H2CO3:___________________________;
NH4HCO3 :___________________________;
Ca(OH)2:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,0.1 mol N2(g)与0.3 mol H2(g)在恒容密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-akJ·molˉ1(a>0)。下列说法正确的是
2NH3(g)ΔH=-akJ·molˉ1(a>0)。下列说法正确的是
A.容器内气体的压强不再发生变化,说明反应达到平衡状态
B.达到化学平衡状态时,正、逆反应速率都为零
C.相同时间内,断开H—H键的数目和生成N-H键的数目相等
D.平衡时容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中A、B是盐,C是碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为_____________。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为_______
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸
① B的化学式为_____________,鉴别溶液B中的阴离子的方法:___________________
② D溶于稀硝酸的离子方程式为________________________________
③ D与E的混合物a g,加入足量盐酸,完全反应生成的气体在标准状况下体积为b L,则求算E在混合物中的质量分数的表达式为________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe3+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对该废液进行处理(所加试剂均稍过量),以回收金属,保护环境。

请回答:
(1)沉淀a中含有的单质是______________________。
(2)沉淀c的化学式是__________________________。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期元素在生产生活中具有重要的作用。请回答下列问题:
(1)基态Sc原子的价电子排布图为___________________。
(2)Zn2+和CN-、K+可组成化合物K2Zn(CN)4,其中存在的化学键类型有____________;Zn(CN)42-中的配体为_______,配位原子为_____ ,与该配离子中配体等电子体的分子为___。
(3)与Br同主族的短周期元素有F、Cl,这三种元素的简单氢化物HF、HCl、HBr的沸点从高到低的顺序为___________,理由为______。
(4)Fe-Cr-Al合金可作为汽车尾气催化剂的载体,汽车尾气催化剂可将NO2还原为无毒害的气体,防止HNO3型酸雨的形成,NO2的空间构型为_____。HNO3的酸性强于HNO2的原因为____________________。
(5)金属铜采用面心立方堆积方式,其晶胞结构如图所示。已知该晶胞的密度为ρg. cm-3,晶胞参数为anm,阿伏伽德罗常数为NA,则铜原子的相对原子质量的表达式为_______(用含有ρ、a、NA的表达式表示)。
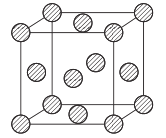
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将电石与水反应产生的气体通入酸性高锰酸钾溶液 | 溶液紫色褪去 | 证明有乙炔生成 |
B | 取CH3COONa溶液于试管中并加入几滴酚酞,再加热 | 溶液红色加深 | CH3COONa溶液显碱性且存在水解平衡 |
C | 向蔗糖溶液中加入稀硫酸,加热几分钟后加入新制Cu(OH)2悬浊液,加热煮沸 | 无红色沉淀生成 | 蔗糖没有发生水解反应生成葡萄糖 |
D | 向Na2S2O3溶液中滴加H2SO4溶液至过量 | 一段时间后溶液变浑浊 | Na2S2O3在该反应中只作氧化剂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列转化的化学方程式,注明反应类型。
(1)甲苯→TNT ___________________
(2)乙烯→聚乙烯__________________
(3)1,3—丁二烯与氯气1,4—加成__________________
(4)溴乙烷和氢氧化钠的乙醇溶液共热___________________
(5)乙醇在铜催化下和氧气反应__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com