
【题目】一定温度下,0.1 mol N2(g)与0.3 mol H2(g)在恒容密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-akJ·molˉ1(a>0)。下列说法正确的是
2NH3(g)ΔH=-akJ·molˉ1(a>0)。下列说法正确的是
A.容器内气体的压强不再发生变化,说明反应达到平衡状态
B.达到化学平衡状态时,正、逆反应速率都为零
C.相同时间内,断开H—H键的数目和生成N-H键的数目相等
D.平衡时容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
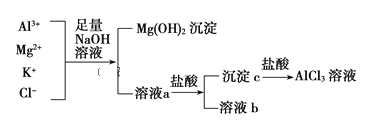
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:_________________。
(2)氢氧化钠溶液能否用氨水代替,为什么?___________________________。
(3)在溶液a中加入盐酸时需控制盐酸的量,为什么?___________。为此,改进方法是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯与水加成制备乙醇的能量变化过程如下图所示。下列说法不正确的是
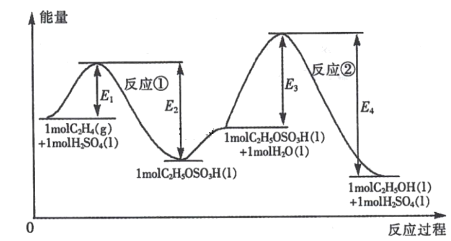
A.H2SO4是该合成过程的催化剂
B.合成过程的速率由反应②决定
C.反应①和反应②均为放热反应
D.C2H4 (g) +H2O(1) =C2H5OH(l )△H =(E1- E4)kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关说法正确的是 ( )
A. 在常温常压下,11.2LO2含有的分子数为0.5NA
B. 71gCl2所含原子数为2NA
C. 标准状况下,22.4LH2O含有的分子数为1NA
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 H2 和钠反应制备氢化钠的装置如右图所示(Zn 粒中含有少量 ZnS 杂质),下列说法不正确的是

A. ①、 ②中依次盛有浓 NaOH 溶液、 浓 H2SO4
B. 管式炉加热前, 用试管收集③处气体并点燃, 通过声音判断气体纯度
C. 结束反应时, 先停止管式炉加热, 再关闭活塞 K
D. 取出瓷舟内的固体, 投入适量水中, 若有气体产生, 即可证明制得了氢化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块表面已部分被氧化为氧化钠的钠块1.08g放入20g水中,得到标准状况下氢气224mL。求:
①被氧化前钠块的质量__________________。
②所得溶液中溶质的质量分数_____________(计算结果均保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
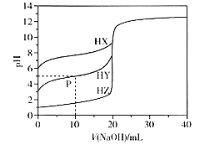
A.电离常数Ka(HX)的数量级为10-12
B.P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C.pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D.HX的电离程度大于X-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10 mg/kg,一种制备黄血盐的工艺如下:
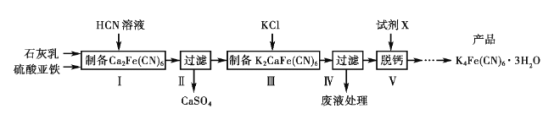
请回答下列问题:
(1)过滤需要用到的玻璃仪器有__________;写出中间产物CaSO4的一种用途__________。
(2)步骤I反应的化学方程式是___________。
(3)步骤V所用的试剂X是________(填化学式),在得到产品前还需经过的步骤包括____。
(4)工艺中用到剧毒的HCN溶液,含CN-等的废水必须处理后才能排放。
①CN-的电子式是_____________。
②处理含CN-废水的方法:第一步NaClO溶液先将CN-不完全氧化为OCN-;第二步NaClO溶液完全氧化OCN-生成N2和两种盐。第二步反应的离子方程式是_____。
(5)已知反应:
3Fe2++2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
现有Fe2+被氧化后的溶液,仅供选择的试剂:铁粉、铁氰化钾溶液、亚铁氰化钾溶液、KSCN溶液,请设计检验Fe2+是否氧化完全的实验方案_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铵与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述中错误的是( )
A.NH4H是离子化合物
B.NH4H溶于水所形成的溶液显酸性
C.NH4H与水反应时,NH4H是还原剂
D.NH4H固体投入少量的水中,有两种气体产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com