
【题目】写出下列转化的化学方程式,注明反应类型。
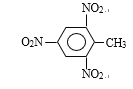
(1)甲苯→TNT ___________________
(2)乙烯→聚乙烯__________________
(3)1,3—丁二烯与氯气1,4—加成__________________
(4)溴乙烷和氢氧化钠的乙醇溶液共热___________________
(5)乙醇在铜催化下和氧气反应__________________
【答案】![]() +3HO-NO2
+3HO-NO2![]()
 +3H2O,取代反应 nCH2=CH2
+3H2O,取代反应 nCH2=CH2![]()
![]() ,加聚反应 CH2=CH-CH=CH2+Cl2
,加聚反应 CH2=CH-CH=CH2+Cl2![]() CH2ClCH=CHCH2Cl,加成反应 CH3CH2Br+NaOH
CH2ClCH=CHCH2Cl,加成反应 CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O,消去反应 2CH3CH2OH+O2
CH2=CH2↑+NaBr+H2O,消去反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O;氧化反应
2CH3CHO+2H2O;氧化反应
【解析】
(1)由于甲基的影响,使得苯环邻位和对位上的氢原子变得活泼,容易被取代,即甲苯→TNT的反应方程式为![]() +3HO-NO2
+3HO-NO2![]()
 +3H2O,该反应为取代反应;
+3H2O,该反应为取代反应;
(2)乙烯→聚乙烯发生加聚反应,其反应方程式为nCH2=CH2![]()
![]() ;
;
(3)1,3-丁二烯与Cl2发生1,4-加成,该反应为加成反应,即反应方程式为CH2=CH-CH=CH2+Cl2![]() CH2ClCH=CHCH2Cl;
CH2ClCH=CHCH2Cl;
(4)溴乙烷在氢氧化钠的乙醇溶液中发生消去反应,即反应方程式为CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O;
CH2=CH2↑+NaBr+H2O;
(5)乙醇发生催化氧化反应,该反应为氧化反应,其反应方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
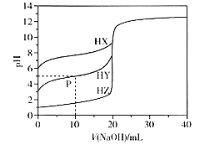
A.电离常数Ka(HX)的数量级为10-12
B.P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C.pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D.HX的电离程度大于X-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
C.将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
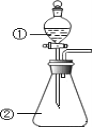
D.用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,开始滴加时就可观察到有白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铵与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述中错误的是( )
A.NH4H是离子化合物
B.NH4H溶于水所形成的溶液显酸性
C.NH4H与水反应时,NH4H是还原剂
D.NH4H固体投入少量的水中,有两种气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部转化到产品中,实现“零排放”。下列反应符合绿色化学这一特点的是( )
A.工业冶炼Fe2O3 + 3CO![]() 2Fe + 3CO2
2Fe + 3CO2
B.实验室制取二氧化碳CaCO3+2HCl=CaCl2+H2O+CO2↑
C.用生石灰制熟石灰CaO+H2O=Ca(OH)2
D.实验室制取氢气Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: X(g)+2Y(g) ![]() 3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列说法正确的是
3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列说法正确的是
A. 达到化学平衡状态时,Y 的正反应速率和 Z 的逆反应速率相等
B. 达到化学平衡状态时,X、Y、Z 的浓度之比为 1 : 2 : 3
C. 达到化学平衡状态时,反应放出的总热量一定小于 a kJ
D. 0.2 mol X 和 0.2 mol Y 充分反应生成 Z 的物质的量一定小于 0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中含氧原子的物质的量一定相同的是
A. 3.36L O2 和 0.3 mol H2O
B. 0.1 mol H2SO4 和 3.6 g H2O
C. 0.1 mol FeSO4·7H2O 和 0.1 mol C12H22O11(蔗糖)
D. 6.02×1023 个 CO2 与 0.1 mol KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中所用少量氯气是用下列方法制取的,MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,试回答下列问题:
MnCl2+Cl2↑+2H2O,试回答下列问题:
(1)该反应是氧化还原反应吗?__________(填“是”或“否”),如果是氧化还原反应,请指出__________是氧化剂,______________是还原剂,____________是氧化产物,______________是还原产物,根据上述氧化还原反应判断氧化性:__________>__________;还原性:__________>____________。
(2)写出该反应的离子方程式______________________________。
(3)用双线桥法标出该反应电子转移的方向和数目__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液相催化还原法去除水体中![]() 是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
Ⅰ.制备Pd-Cu/TiO2的反应过程如下图所示,光照使TiO2发生电荷分离,将金属Pd沉积在TiO2表面。再用类似方法沉积Cu,得到在TiO2纳米颗粒表面紧密接触的Pd-Cu纳米簇。
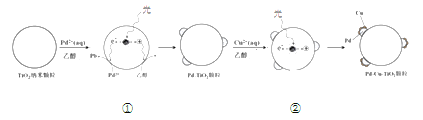
(1)该过程中,乙醇发生__________(填“氧化”或“还原”)反应。
(2)请在②中补全光照条件下形成Pd-Cu纳米簇的反应过程示意图_______。
Ⅱ.Pd-Cu/TiO2分步催化还原机理如图a所示。其他条件相同,不同pH时,反应1小时后![]() 转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
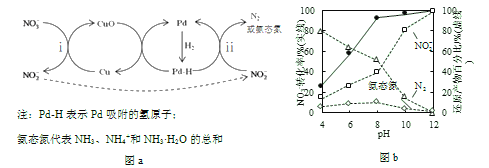
(3)该液相催化还原法中所用的还原剂是__________。
(4)i的离子方程式是__________。
(5)研究表明,OH–在Pd表面与![]() 竞争吸附,会降低Pd吸附
竞争吸附,会降低Pd吸附![]() 的能力,但对Pd吸附H的能力影响不大。
的能力,但对Pd吸附H的能力影响不大。
①随pH增大,N2和氨态氮在还原产物中的百分比均减小,原因是____________,导致反应ⅱ的化学反应速率降低。
②随pH减小,还原产物中![]() 的变化趋势是__________,说明Pd表面吸附的
的变化趋势是__________,说明Pd表面吸附的![]() 和H的个数比变大,对反应__________(用离子方程式表示)更有利。
和H的个数比变大,对反应__________(用离子方程式表示)更有利。
(7)使用Pd-Cu/TiO2,通过调节溶液pH,可将![]() 尽可能多地转化为N2,具体方法是__________。
尽可能多地转化为N2,具体方法是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com