
【题目】液相催化还原法去除水体中![]() 是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
Ⅰ.制备Pd-Cu/TiO2的反应过程如下图所示,光照使TiO2发生电荷分离,将金属Pd沉积在TiO2表面。再用类似方法沉积Cu,得到在TiO2纳米颗粒表面紧密接触的Pd-Cu纳米簇。
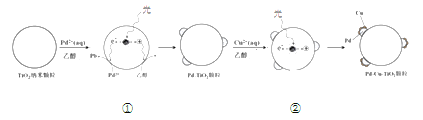
(1)该过程中,乙醇发生__________(填“氧化”或“还原”)反应。
(2)请在②中补全光照条件下形成Pd-Cu纳米簇的反应过程示意图_______。
Ⅱ.Pd-Cu/TiO2分步催化还原机理如图a所示。其他条件相同,不同pH时,反应1小时后![]() 转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
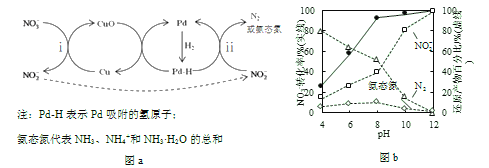
(3)该液相催化还原法中所用的还原剂是__________。
(4)i的离子方程式是__________。
(5)研究表明,OH–在Pd表面与![]() 竞争吸附,会降低Pd吸附
竞争吸附,会降低Pd吸附![]() 的能力,但对Pd吸附H的能力影响不大。
的能力,但对Pd吸附H的能力影响不大。
①随pH增大,N2和氨态氮在还原产物中的百分比均减小,原因是____________,导致反应ⅱ的化学反应速率降低。
②随pH减小,还原产物中![]() 的变化趋势是__________,说明Pd表面吸附的
的变化趋势是__________,说明Pd表面吸附的![]() 和H的个数比变大,对反应__________(用离子方程式表示)更有利。
和H的个数比变大,对反应__________(用离子方程式表示)更有利。
(7)使用Pd-Cu/TiO2,通过调节溶液pH,可将![]() 尽可能多地转化为N2,具体方法是__________。
尽可能多地转化为N2,具体方法是__________。
【答案】氧化  H2 Cu+NO3- = NO2-+CuO 或 H2+NO3-
H2 Cu+NO3- = NO2-+CuO 或 H2+NO3-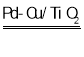 NO2-+ H2O Pd表面单位面积吸附的
NO2-+ H2O Pd表面单位面积吸附的![]() 数目减小 增大 2NO2-+6H = N2+4H2O+2OH- 先调节溶液的pH到12,待NO3-几乎完全转化为NO2-后,调节pH到4
数目减小 增大 2NO2-+6H = N2+4H2O+2OH- 先调节溶液的pH到12,待NO3-几乎完全转化为NO2-后,调节pH到4
【解析】
根据制备Pd-Cu/TiO2的反应过程示意图,Cu2+、Pb2+得电子发生还原反应,则乙醇发生氧化反应。Pd-Cu/TiO2分两步催化硝酸根离子的转化反应,先将硝酸根离子还原为亚硝酸根离子,再将亚硝酸根离子还原为氮气或氨态氮。
(1)根据制备Pd-Cu/TiO2的反应过程示意图中①,Pb2+得电子发生还原反应,则乙醇发生氧化反应。
(2)根据①的示意图,②中铜离子应得电子生成铜,乙醇与其发生反应,则光照条件下形成Pd-Cu纳米簇的反应过程②示意图为 。
。
(3)根据图a可知,氢气生成氨态氮,氢元素的化合价升高,失去电子,作该液相催化还原法中还原剂。
(4)i中铜与硝酸根离子反应生成亚硝酸根离子和铜离子,或Pd-Cu/TiO2作催化剂,硝酸根离子与氢气发生氧化还原反应生成亚硝酸根离子和水,根据得失电子守恒,得到离子方程式Cu+NO3- = NO2-+CuO 或 H2+NO3-![]() NO2-+ H2O。
NO2-+ H2O。
(5)①因为OH–在Pd表面与NO2-竞争吸附,会降低Pd吸附NO2-的能力,随pH增大,OH–浓度增大,导致Pd表面单位面积吸附的 NO2-数目减小,N2和氨态氮在还原产物中的百分比均减小,反应ⅱ的化学反应速率降低。
②根据图b所示,随pH减小,n(N2)增大,n(氨态氮)变化不大,则还原产物中![]() 增大,Pd表面吸附的NO2-和H的个数比变大,NO2-更易转化为N2,根据得失电子守恒,得到对应的离子方程式为2NO2-+6H = N2+4H2O+2OH-。
增大,Pd表面吸附的NO2-和H的个数比变大,NO2-更易转化为N2,根据得失电子守恒,得到对应的离子方程式为2NO2-+6H = N2+4H2O+2OH-。
(7)根据图b所示,pH=12时,NO2-所占的物质的量的百分比最高,pH=4时,N2所占的物质的量的百分比最高,所以先调节溶液的pH到12,待NO3-几乎完全转化为NO2-后,调节pH到4使用Pd-Cu/TiO2,通过调节溶液pH,可将NO3-尽可能多地转化为N2。


科目:高中化学 来源: 题型:
【题目】写出下列转化的化学方程式,注明反应类型。
(1)甲苯→TNT ___________________
(2)乙烯→聚乙烯__________________
(3)1,3—丁二烯与氯气1,4—加成__________________
(4)溴乙烷和氢氧化钠的乙醇溶液共热___________________
(5)乙醇在铜催化下和氧气反应__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种化合物,分别由K+、Ba2+、SO42—、CO32、OH—中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D的化学式。
A、________,B、________,C、________,D、________。
(2)写出下列反应的离子方程式。
B与盐酸反应:_______________________________________________,
C与硫酸反应:_______________________________________________,
E(少量)与澄清石灰水反应:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣![]() 主要成分为
主要成分为![]() 、
、![]() 和少量Fe、Cu的氧化物
和少量Fe、Cu的氧化物![]() 为原料制备
为原料制备![]() 实验过程如下:
实验过程如下:

![]() 酸溶过程中,
酸溶过程中,![]() 发生的化学方程式为______。
发生的化学方程式为______。
![]() 加入
加入![]() 的作用为______。
的作用为______。
![]() 下列关于分液漏斗及其使用方法的叙述,正确的是______
下列关于分液漏斗及其使用方法的叙述,正确的是______![]() 。
。
A 使用前要先检查玻璃塞和旋塞处是否漏液
B 将加入有机萃取剂后的混合液转移到分液漏斗中,塞上玻璃塞,用右手压住分液漏斗玻璃塞,左手握住旋塞,倒转漏斗,用力振荡,并不时旋开旋塞放气
C 分液时,必须塞紧上口玻璃塞,保证密封,以防止有机萃取剂挥发
D 本实验中,含![]() 的有机相一定从下口放出,水层从上口倒出
的有机相一定从下口放出,水层从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,按要求作答:

(1)写出图中实验操作的名称:①_____ ③_____
(2)装置④中所有玻璃仪器的名称:_____,_____
(3)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
从 KCl溶液中获取KCl晶体_____;从海水中提取水_____;分离CaCO3和水_____;分离植物油和水_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“硫代硫酸银”( [ Ag(S2O3)2]3–)常用于切花保鲜,由AgNO3溶液(0.1 mol·L–1 、pH=6)和Na2S2O3溶液(0.1 mol·L–1、pH=7)现用现配制。某小组探究其配制方法。
(实验一)

(1)A为Ag2S2O3。写出生成A的离子方程式__________。
(2)对实验现象的分析得出,试管a中充分反应后一定生成了__________(填离子符号)。进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。做出推测的理由是__________。
(3)若试管a中物质充分反应后不过滤,继续加入1.1 mL Na2S2O3溶液,振荡,静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因:__________。
结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
(实验二)已知:Ag2S2O3 +3S2O32- ![]() 2 [ Ag(S2O3)2]3–(无色)
2 [ Ag(S2O3)2]3–(无色)
实验操作 | 实验现象 |
i. | 白色沉淀生成,振荡后迅速溶解,得到无色清液; 滴加至约1 mL时清液开始略显棕黄色,有丁达尔现象; 超过1.5 mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色; 滴加完毕,静置,得到黑色沉淀,上层清液pH = 5 |
ii. | 白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象。 |
(4)用平衡移动原理解释实验i中加入1.5 mL AgNO3后产生白色沉淀的原因:__________。
(5)实验i中,当加入0.5 mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是__________。
(6)简述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请仔细观察以下2个装置,下列说法正确的是
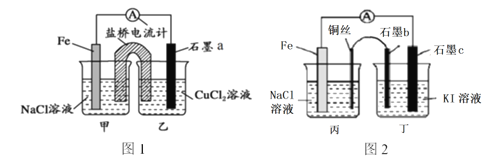
A. 图1石墨a为正极,图2石墨c也为正极
B. 图1是原电池装置,盐桥的作用是使电解质溶液始终保持电中性,以提供持续稳定的电流,图2装置不会产生电流
C. 图1石墨a电极上发生的反应为:O2+2H2O+4e-=4OH-
D. 图2石墨b上的产物能使淀粉溶液变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含有Na2O杂质的Na2O2试样,一个化学实验小组利用H2O与Na2O2的反应来测定该样品的纯度。可供选择的装置如下:

请回答下列问题:
(1)装置⑤中仪器a的名称是______。
(2)用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置。
Ⅰ.该实验装置的组合是________(填字母)。
a. ①④⑤ b. ①③⑤ c. ②④⑤ d. ③⑤⑥
Ⅱ.所选用装置的连接顺序应是__________(填各接口的字母,连接胶管省略)。
(3)写出实验中Na2O2发生反应的化学方程式_____________。
(4)用上述实验后所得溶液配制成浓度为1.0mol/L的溶液,回答下列问题。
①向400mL该溶液中通入0.3mol CO2,则所得溶液中HCO3–和CO32–的物质的量浓度之比约为___________。
A. 1:3 B. 1:2 C. 2:1 D. 3:1
②将上述溶液蒸发结晶得到Na2CO3和NaHCO3固体混合物,下列选项中不能准确测定混合物中Na2CO3质量分数的是____________。
a. 取a g混合物充分加热,在干燥器中冷却至室温,减重b g
b. 取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
c. 取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g
d. 取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出次氯酸的结构式________;
(2)NaHCO3的俗名是_______;
(3)第四周期第ⅦA原子序数为______,元素符号为_________,其最高价氧化物的水化物化学式为_______;
(4)写出工业上制氯气的离子方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com