
【题目】反应:xA(气)+yB(气)![]() zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
A. x+y<z B. 平衡向右移动
C. B的转化率升高 D. C的体积分数降低
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中,能大量共存的是( )
A.Na+、CO32﹣、Ca2+、NO3﹣
B.Na+、NO3﹣、Al3+、Cl﹣
C.K+、SO42﹣、Cl﹣、Cu2+
D.Ba2+、Cl﹣、K+、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的下列性质中,可以证明它是弱电解质的是
A. 0.1mol/L醋酸溶液的c(H+)约为1×10-3mol/L
B. 醋酸能与水以任何比例互溶
C. 10mL 1mol/L醋酸恰好与10mL 1mol/L NaOH溶液完全反应
D. 醋酸溶液的导电性比盐酸溶液的弱
【答案】A
【解析】0.1mol/L醋酸溶液的c(H+)约为1×10-3mol/L,说明醋酸只电离了一部分,所以是弱电解质,选项A正确。醋酸能与水以任何比例互溶是醋酸的物理性质,这个与电解质的强弱无关,选项B错误。10mL 1mol/L的一元酸(无论强弱)都会恰好与10mL 1mol/L NaOH溶液完全反应,所以选项C错误。因为没有说明浓度的关系,所以醋酸溶液的导电性比盐酸溶液的弱,并不能说明醋酸是弱电解质,选项D错误。
点睛:证明一个一元酸HA是弱电解质的方法主要有:
配成0.1mol/L的溶液,测得氢离子浓度小于0.1mol/L,或者测得pH>1。
测NaA的溶液的酸碱性,得到该溶液显碱性。
配成相同浓度的HA和HCl溶液,测得HA的导电性较差。
【题型】单选题
【结束】
16
【题目】下列表示化学过程的化学用语书写正确的是
A. BaSO4投入水中后建立的沉淀溶解平衡:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O![]() 2Al(OH)3↓
2Al(OH)3↓
C. HCO3-的电离:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Na2SO3的水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl﹣的物质的量浓度之比( )
A.5:2
B.3:1
C.15:2
D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是

A. X→Y反应类型为酯化反应
B. X、Y、Z均能使溴的四氯化碳溶液褪色
C. Y和Z互为同分异构体
D. 等物质的量的X、Z分别与足量Na反应,消耗Na的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D 原子序数依次增大且最外层电子数之和为17。B、D 同主族,短周期中C原子半径最大,B最外层电子数是次外层的3倍。下列推断不正确的是
A. 元素B、C、D 形成的化合物的水溶液呈中性
B. 元素B、C 形成的化合物中可能既含有离子键又含共价键
C. 离子半径从大到小的顺序为D>B>C
D. 元素B 的简单气态氢化物的热稳定性比D 的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于同分异构体的叙述正确的是
A. 相对分子质量相同而结构不同的化合物互称为同分异构体
B. 化学式相同而结构不同的化合物互称为同分异构体
C. 同分异构体之间由于分子组成相同,所以它们的性质相同
D. 只有少数的有机物之间存在同分异构现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水CaCl2具有强烈的吸湿性,在空气中易潮解,可用作干燥剂、脱水剂、混凝防冻剂等。以工业碳酸钙矿石(含有少量SiO2 、Fe2O3、Al2O3、FeCO3等杂质)生产无水氯化钙的主要流程如下:
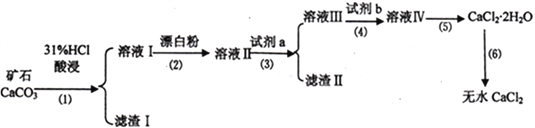
(1)为了提高步骤(1)的反应速率,可以采取的措施是________________________。
(2)加入试剂b 的目的是使溶液酸化,试剂b 可以选择下列试剂__________(填序号)。
①硫酸 ②硝酸 ③氢硫酸 ④盐酸
(3)写出步骤(2)的离子方程式______________________________。
(4)步骤(5)用到的操作方法有蒸发浓缩、______________________________。
(5)已知A13+、Fe2+、Fe3+生成氢氧化物沉淀的pH 如下:
Al (OH)3 | Fe(OH)2 | Fe(OH)3 | |||
开始沉淀 | 3.7 | 开始溶解 | 7.8 | 6.5 | 1.5 |
沉淀完全 | 5.3 | 完全溶解 | 10.0 | 9.7 | 3.3 |
加入试剂a的目的是调节溶液的pH,调节pH 的范围为_______________________________。
(6)已知某一温度时Ksp[Fe(OH)3]=8.0×10-38,向0.01 mol·L-1的FeCl3 溶液中加入NaOH 固体,假设溶液的体积不变,要生成Fe(OH)3沉淀,应使溶液中的c(OH-)最小为__________mol·L-1;Fe3+沉淀完全时,溶液中c(OH-) 最小为__________mol·L-1。
(7)测定样品中Cl-含量的方法是:a.称取0.7500g 样品,溶解,在250mL 容量瓶中定容;b.量取25.00mL 待测液于锥形瓶中; c.用0.05000mol·L-1AgNO3 溶液滴定至终点,消耗AgNO3溶液体积的平均值为25.00mL。计算上述样品中CaCl2 的质量分数为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com