
【题目】0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl﹣的物质的量浓度之比( )
A.5:2
B.3:1
C.15:2
D.1:3
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. 溶液中OH-向电极a移动
B. O2在电极b上发生还原反应
C. 反应消耗的NH3与O2的物质的量之比为4:5
D. 电极a的反应式为2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】![]() __________
__________
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
|
|
|
稀硫酸 | ||
1 | 3.0 | 2.0 | 1.0 | 2.0 | 4.0 |
2 | 2.0 | 3.0 | 1.0 | 2.0 | 5.2 |
3 | 1.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________。
(2)利用实验1中数据计算,用![]() 的浓度变化表示的平均反应速率为:
的浓度变化表示的平均反应速率为: ![]() _____________
_____________
(3)该小组同学根据经验绘制了![]() 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中![]() 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
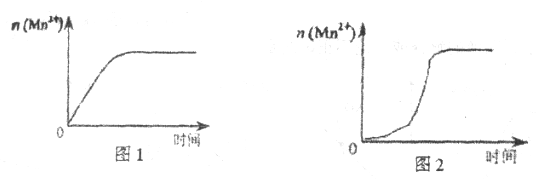
①该小组同学提出的假设是____________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
|
|
|
稀硫酸 | |||
4 | 3.0 | 2.0 | 1.0 | 2.0 | ____ | t |
③若该小组同学提出的假设成立,应观察到的现象是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组离子在指定溶液中一定能大量共存的是 ( )
A. 能使紫色石蕊试液变红的溶液:Mg2+、Na+、NO3-、Cl-
B. 0.1 mol·L-1 NH4Cl溶液:Na+、Ca2+、OH-、CO32-
C. 0.1 mol·L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、I-
D. 与Al反应能产生H2的溶液:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。回答下列问题:
(1)已知反应的热化学方程式如下:
①N2H4(g)![]() N2(g)+2H2(g) △H1;
N2(g)+2H2(g) △H1;
②N2(g)+3H2(g)![]() 2NH3(g) △H2。
2NH3(g) △H2。
反应热△H1 _____(填“大于”或“小于”) △H2。向2 L的恒容密闭容器中充入1 mol N2H4,发生反应①,![]() (用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=___________________。
(用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=___________________。

(2)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系。
①该反应的化学方程式为________________________________________。
②p2_______ (填“大于”或“小于”) p1。
③图中N2H4的平衡体积分数随温度升高而降低,其原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:xA(气)+yB(气)![]() zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
A. x+y<z B. 平衡向右移动
C. B的转化率升高 D. C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HR是一元酸。室温时,用0.250 mo·L-1NaOH 溶液滴定25.0 mLHR溶液时,溶液的pH 变化情况如图所示。其中,b 点表示两种物质恰好完全反应。下列叙述正确的是

A. HR 的电离常数Ka=5×10-6
B. 图中X<7
C. a 点溶液中粒子浓度大小关系是:c(Na+)>c(R-)>c(HR)>c(H+)>c(OH-)
D. b 点溶液中粒子浓度大小关系是:c(Na+)>c(OH-)>c(R-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将 20.0 g 质量分数为 14.0%的 KNO3溶液与 30.0 g 质量分数为 24.0%的 KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算:
(1)混合后溶液的质量分数_________。
(2)混合后溶液的物质的量浓度_______。
(3)在1000g水中需溶解______molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
(4)标况下44.8LHCl溶于水配成500mL溶液。计算:
①HCl的物质的量____________________;
②所得溶液中溶质的物质的量浓度____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com