
【题目】肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。回答下列问题:
(1)已知反应的热化学方程式如下:
①N2H4(g)![]() N2(g)+2H2(g) △H1;
N2(g)+2H2(g) △H1;
②N2(g)+3H2(g)![]() 2NH3(g) △H2。
2NH3(g) △H2。
反应热△H1 _____(填“大于”或“小于”) △H2。向2 L的恒容密闭容器中充入1 mol N2H4,发生反应①,![]() (用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=___________________。
(用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=___________________。

(2)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系。
①该反应的化学方程式为________________________________________。
②p2_______ (填“大于”或“小于”) p1。
③图中N2H4的平衡体积分数随温度升高而降低,其原因是__________________________________。
【答案】 大于 0.25 3N2H4![]() 4NH3+N2 小于 肼在催化剂作用下分解,正反应为吸热反应,升髙温度,平衡正向移动,因此肼的体积分数也减小
4NH3+N2 小于 肼在催化剂作用下分解,正反应为吸热反应,升髙温度,平衡正向移动,因此肼的体积分数也减小
【解析】(1)①N2H4(g)![]() N2(g)+2H2(g) 为分解反应,属于吸热反应,△H1>0;②N2(g)+3H2(g)
N2(g)+2H2(g) 为分解反应,属于吸热反应,△H1>0;②N2(g)+3H2(g)![]() 2NH3(g) 为化合反应,属于放热反应,△H2<0,反应热△H1大于△H2。设反应的N2H4的物质的量为y,
2NH3(g) 为化合反应,属于放热反应,△H2<0,反应热△H1大于△H2。设反应的N2H4的物质的量为y,
N2H4(g)![]() N2(g)+2H2(g)
N2(g)+2H2(g)
起始(mol)1 0 0
反应 y y 2y
平衡 1-y y 2y
则![]() =
=![]() =3.0,解得y=0.5mol,因此K=
=3.0,解得y=0.5mol,因此K=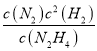 =
=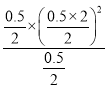 =0.25,故答案为:大于;0.25;
=0.25,故答案为:大于;0.25;
(2)①气态肼在催化剂作用下分解只产生两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝色,可推断两种气体分别为N2和NH3,反应方程式为:3N2H4![]() N2+4NH3,故答案为:3N2H4
N2+4NH3,故答案为:3N2H4![]() N2+4NH3;
N2+4NH3;
②反应为气体物质的量增大的反应,减小压强有利于化学平衡向正反应方向移动,达到平衡时,肼的体积分数减小,根据图像,压强大小关系为:p2<p1,故答案为:小于;
③N2H4的平衡体积分数随温度升高而降低,可能的原因为肼在催化剂作用下分解,正反应为吸热反应,升髙温度,平衡正向移动,因此肼的体积分数也减小,故答案为:肼在催化剂作用下分解,正反应为吸热反应,升髙温度,平衡正向移动,因此肼的体积分数也减小。


科目:高中化学 来源: 题型:
【题目】有一种新型的乙醇电池,它用磺酸类质子溶剂,在200 ℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为C2H5OH+3O2===2CO2+3H2O,电池示意如图,下列说法不正确的是( )

A. a极为电池的负极
B. 电池工作时,电流由b极沿导线经灯泡再到a极
C. 电池正极的电极反应为4H++O2+4e-===2H2O
D. 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物中,既不能与NaOH溶液发生反应,又不能与溴的CCl4溶液反应,也不能使酸性KMnO4溶液褪色的是( )
A.丙烷B.乙醇C.盐酸D.乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl﹣的物质的量浓度之比( )
A.5:2
B.3:1
C.15:2
D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式如下图,下列说法不正确的是
![]()
A. 咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B. 1mol 咖啡酸最多能与5 mol H2反应
C. 咖啡酸分子中所有原子可能共面
D. 蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A 的分子式为C8H10O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D 原子序数依次增大且最外层电子数之和为17。B、D 同主族,短周期中C原子半径最大,B最外层电子数是次外层的3倍。下列推断不正确的是
A. 元素B、C、D 形成的化合物的水溶液呈中性
B. 元素B、C 形成的化合物中可能既含有离子键又含共价键
C. 离子半径从大到小的顺序为D>B>C
D. 元素B 的简单气态氢化物的热稳定性比D 的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=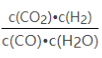 ,在不同的温度下该反应的平衡常数如下表:
,在不同的温度下该反应的平衡常数如下表:

下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在一定体积的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 若平衡浓度符合下列关系式: ![]() ,则此时的温度为1000℃
,则此时的温度为1000℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com