
ЎҫМвДҝЎҝУРТ»ЦЦРВРНөДТТҙјөзіШЈ¬ЛьУГ»ЗЛбАаЦКЧУИЬјБЈ¬ФЪ200 ЎжЧуУТКұ№©өзЈ¬ТТҙјөзіШұИјЧҙјөзіШР§ВКёЯіц32ұ¶ЗТёь°ІИ«ЎЈөзіШЧЬ·ҙУҰОӘC2H5OHЈ«3O2===2CO2Ј«3H2OЈ¬өзіШКҫТвИзНјЈ¬ПВБРЛө·ЁІ»ХэИ·өДКЗ( )

A. aј«ОӘөзіШөДёәј«
B. өзіШ№ӨЧчКұЈ¬өзБчУЙbј«СШөјПЯҫӯөЖЕЭФЩөҪaј«
C. өзіШХэј«өДөзј«·ҙУҰОӘ4HЈ«Ј«O2Ј«4eЈӯ===2H2O
D. өзіШ№ӨЧчКұЈ¬1 molТТҙјұ»Сх»ҜКұҫНУР6 molөзЧУЧӘТЖ
Ўҫҙр°ёЎҝD
ЎҫҪвОцЎҝ
УЙЦКЧУөД¶ЁПтТЖ¶ҜҝЙЦӘaОӘёәј«Ј¬bОӘХэј«Ј¬ёәј«·ўЙъСх»Ҝ·ҙУҰЈ¬ТТҙјұ»Сх»ҜЙъіЙCO2әНЈ¬өзј«·ҙУҰКҪОӘC2H5OHЈӯ12eЈӯЈ«3H2O=2CO2ЎьЈ«12HЈ«Ј¬Хэј«СхЖшөГөҪөзЧУұ»»№ФӯЈ¬өзј«·ҙУҰКҪОӘ4H++O2+4e-=2H2OЈ¬ҪбәПөзј«·ҙУҰҪвҙрёГМвЎЈ
AЈ®ФӯөзіШ№ӨЧчКұЈ¬СфАлЧУПтХэј«ТЖ¶ҜЈ¬ФтaОӘёәј«Ј¬СЎПоAХэИ·Ј»BЈ®өзіШ№ӨЧчКұЈ¬өзБчУЙХэј«ҫӯНвөзВ·БчПтёәј«Ј¬ФЪёГөзіШЦРУЙbј«БчПтaј«Ј¬СЎПоBХэИ·Ј»CЈ®Хэј«СхЖшөГөҪөзЧУұ»»№ФӯЈ¬өзј«·ҙУҰКҪОӘ4HЈ«Ј«O2Ј«4eЈӯ=2H2OЈ¬СЎПоCХэИ·Ј»DЎўТТҙјИјБПЛбРФөзіШёәј«өзј«·ҙУҰОӘC2H5OHЈӯ12eЈӯЈ«3H2O=2CO2ЎьЈ«12HЈ«Ј¬Хэј«·ҙУҰКҪЈә4HЈ«Ј«O2Ј«4eЈӯ=2H2OЈ¬СЎПоDІ»ХэИ·ЎЈҙр°ёСЎDЎЈ


 ёЯЦРұШЛўМвПөБРҙр°ё
ёЯЦРұШЛўМвПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРОпЦКЦРЈәAЈ®KIЈЁsЈ© BЈ®C2H5OHЈЁlЈ© CЈ®Cl2ЈЁgЈ© DЈ®CH3COOHЈЁlЈ©EЈ®BaSO4ЈЁsЈ© FЈ®NaHSO4ЈЁaqЈ©ЎЎGЈ®КҜД«ЈЁsЈ©ЎЎHЈ®ХбМЗЈЁsЈ©ЎЎIЈ®NaOHЈЁlЈ© J.БтЛб K.СОЛб
ЈЁ1Ј©КфУЪ·ЗөзҪвЦКөДКЗ____________ЈЁМоРтәЕЈ¬ПВН¬Ј©Ј¬КфУЪЗҝөзҪвЦКөДКЗ____________Ј¬КфУЪИхөзҪвЦКөДКЗ____________ЎЈ
ЈЁ2Ј©ДЬЦұҪУөјөзөДКЗ________________Ј¬өзҪвЦКЦРДЬИЬУЪЛ®,ЗТЛ®ИЬТәДЬөјөзКЗ________________ЎЈ
Ўҫҙр°ёЎҝ BH AEI J D FGIK ADIJ
ЎҫҪвОцЎҝөзҪвЦККЗЛбЎўјоЎўСОәН»оЖГҪрКфСх»ҜОпЈ¬·ЗөзҪвЦККЗіэБЛөзҪвЦКЦ®НвөДЛщУР»ҜәПОпЎЈЗҝөзҪвЦККЗЗҝЛбЎўЗҝјоәНСОЈ¬ИхөзҪвЦККЗИхЛбЎўИхјоәНЛ®ЎЈЧўТвЈәөҘЦКјИІ»КЗөзҪвЦКТІІ»КЗ·ЗөзҪвЦКЎЈЈЁ1Ј©КфУЪ·ЗөзҪвЦКөДКЗТТҙјәНХбМЗЈ¬ЗҝөзҪвЦККЗөв»ҜјШЈЁСОЈ©ЎўБтЛбұөЎўЗвСх»ҜДЖәНБтЛбЈЁЧўТвЈәFКЗБтЛбЗвДЖИЬТәЈ¬KКЗHClИЬТәЈ¬¶јКфУЪ»мәПОпЈ©Ј¬ИхөзҪвЦККЗҙЧЛбЎЈ
ЈЁ2Ј©№ММеөјөзТӘЗуКЗҪрКф»тХЯКҜД«Ј¬ИЫИЪЧҙМ¬өјөзөДТӘЗуКЗАлЧУ»ҜәПОпЈ¬ИЬТәөјөзТӘЗуКЗИЬТәЦРҙжФЪДЬЦ»УРТЖ¶ҜөДАлЧУЈЁөзҪвЦКөзАлЈ©ЎЈЛщТФЦұҪУөјөзөДКЗБтЛбЗвДЖИЬТәЎўКҜД«ЎўЗвСх»ҜДЖИЬТәЎўСОЛбЎЈКфУЪөзҪвЦКЈ¬ДЬИЬУЪЛ®Ј¬ЗТДЬөјөзЈЁұҫМхјю¶аУаЈ¬өзҪвЦКДЬИЬУЪЛ®Ј¬ФтЖдИЬТәТ»¶ЁөјөзЈ©өДКЗөв»ҜјШЎўҙЧЛбЎўЗвСх»ҜДЖЎўБтЛбЎЈБтЛбұөІ»ИЬЎЈ
ЎҫМвРНЎҝМоҝХМв
ЎҫҪбКшЎҝ
18
ЎҫМвДҝЎҝёщҫЭПВБРКВКөЈ¬НкіЙПа№ШөДАлЧУ·ҪіМКҪ»т»ҜС§КҪЈ¬ұШТӘКұҝЙјУТ»¶ЁОДЧЦЛөГчЈә
ЈЁ1Ј©БтЛбВБјШ[Гч·ҜKAlЈЁSO4Ј©2ЎӨ12H2O]ҝЙТФЧчҫ»Л®јБ_____________________ЎЈ
ЈЁ2Ј©ЕЭДӯГр»рЖчөД»ҜС§ФӯАн________________________________________________ЎЈ
ЈЁ3Ј©ИИөДҙҝјоИЬТәЗеПҙУНОЫ___________________________________________ЎЈ
ЈЁ4Ј©јУИИХфёЙFeCl2Л®ИЬТәІўЧЖЙХЈ¬өГөҪОпЦКөД»ҜС§КҪОӘ___________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРҪвКНКВКөөДАлЧУ·ҪіМКҪІ»ХэИ·өДКЗ
A. ВБЖ¬·ЕИлNaOH ИЬТәЦРУРЖшМеІъЙъ: 2Al+ 2OH-+ 2H2O=2AlO2-+3H2Ўь
B. ПтK2Cr2O7ИЬТәЦРөОјУЙЩБҝЕЁH2SO4,ИЬТәіИЙ«јУЙо:Cr2O72-(іИЙ«)+ H2O![]() 2CrO42-(»ЖЙ«) + 2H+
2CrO42-(»ЖЙ«) + 2H+
C. УГNa2CO3ИЬТәҪюЕЭ№шВҜЛ®№ё(ә¬CaSO4):CaSO4 + CO32- ![]() CaCO3+ SO42-
CaCO3+ SO42-
D. ПтNa2SiO3ИЬТәЦРНЁИл№эБҝCO2ЦЖёч№иЛбДэҪә:SiO32-+ CO2 + H2O=H2SiO3(ҪәМе) + CO32-
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҪсУР0.1mol/L NaClИЬТә300mLЈ¬0.1mol/L MgCl2ИЬТә200mLәН0.1mol/LAlCl3ИЬТә100mLЈ¬ХвИэЦЦИЬТәЦРВИАлЧУЕЁ¶ИЦ®ұИКЗ Ј®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝөз»ҜС§ЖшГфҙ«ёРЖчҝЙУГУЪјаІв»·ҫіЦРNH3өДә¬БҝЈ¬Жд№ӨЧчФӯАнКҫТвНјИзПВЎЈПВБРЛө·ЁІ»ХэИ·өДКЗЈЁ Ј©

A. ИЬТәЦРOH-Птөзј«aТЖ¶Ҝ
B. O2ФЪөзј«bЙП·ўЙъ»№Фӯ·ҙУҰ
C. ·ҙУҰПыәДөДNH3УлO2өДОпЦКөДБҝЦ®ұИОӘ4:5
D. өзј«aөД·ҙУҰКҪОӘ2NH3-6e-+6OH-ЈҪN2+6H2O
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПЦҙъіЗКРК№УГөДИјБПҙу¶аКЗГәЖшЎўТә»ҜКҜУНЖшЎЈГәЖшөДЦчТӘіЙ·ЦКЗТ»Сх»ҜМјәНЗвЖшЈ¬УЙГәМҝУлЛ®(ХфЖш)·ҙУҰЦЖөГЈ¬№КУЦіЖЛ®ГәЖшЎЈ
(1)РҙіцЦЖИЎГәЖшөДЦчТӘ·ҙУҰөД»ҜС§·ҪіМКҪ_______________ЎЈ
(2)Тә»ҜКҜУНЖшөДЦчТӘіЙ·ЦКЗұыНйЈ¬ұыНйИјЙХөДИИ»ҜС§·ҪіМКҪОӘC3H8(g)Ј«5O2(g)===3CO2(g)Ј«4H2O(l)ЎЎҰӨHЈҪЈӯ2 220.0 kJ/molЎЈТСЦӘCOЖшМеИјЙХөДИИ»ҜС§·ҪіМКҪОӘCO(g)Ј«![]() O2(g)===CO2(g)ЎЎҰӨHЈҪЈӯ282.57 kJ/molЎЈКФұИҪПН¬ОпЦКөДБҝөДC3H8әНCOИјЙХЈ¬ІъЙъИИБҝөДұИЦөФјОӘ________ЎЈ
O2(g)===CO2(g)ЎЎҰӨHЈҪЈӯ282.57 kJ/molЎЈКФұИҪПН¬ОпЦКөДБҝөДC3H8әНCOИјЙХЈ¬ІъЙъИИБҝөДұИЦөФјОӘ________ЎЈ
(3)ТСЦӘЗвЖшИјЙХөДИИ»ҜС§·ҪіМКҪОӘ2H2(g)Ј«O2(g)===2H2O(l)ЎЎҰӨHЈҪЈӯ571.6 kJ/molЎЈ
КФұИҪПН¬ЦКБҝөДЗвЖшәНұыНйИјЙХЈ¬ІъЙъИИБҝөДұИЦөФјОӘ________ЎЈ
(4)ЗвЖшКЗОҙАҙөДРВДЬФҙЈ¬іэІъЙъҙуБҝИИНвЈ¬»№ҫЯУРөДУЕөгКЗ__________(МоБҪөг)ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТФ¶иРФөзј«өзҪвCuSO4әНNaCl өД»мәПИЬТәЈ¬БҪөзј«ЙПІъЙъөДЖшМе(ұкЧјЧҙҝцПВІв¶Ё)Ме»эИзПВНјЛщКҫЈ¬ПВБРУР№ШЛө·ЁХэИ·өДКЗ
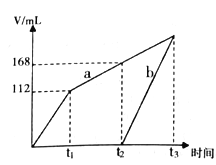
A. ФӯИЬТәЦРCuSO4әНNaClОпЦКөДБҝЦ®ұИОӘ1:1
B. aұнКҫТхј«ЙПІъЙъөДЖшМеЈ¬З°ІъЙъөДОӘCl2
C. Ифt1КұИЬТәөДМе»эОӘ1LЈ¬ҙЛКұИЬТәөДpH ОӘ13
D. ИфФӯИЬТәМе»эОӘ1LЈ¬ФтФӯИЬТәЦРSO42- өДОпЦКөДБҝЕЁ¶ИОӘ0.2 mol/L
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ»ҜС§ЙПіЈУГAG ұнКҫИЬТәЦРөДЛбјо¶И,AG=lg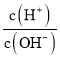 ЎЈ25ЎжКұ,УГ0.100molЎӨL-1өДNaOH ИЬТәөО¶Ё20.00mL 0.100molЎӨL-1HNO2ИЬТә,AGУлЛщјУNaOH ИЬТәөДМе»э(V)№ШПөИзНјЛщКҫЈ¬ПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
ЎЈ25ЎжКұ,УГ0.100molЎӨL-1өДNaOH ИЬТәөО¶Ё20.00mL 0.100molЎӨL-1HNO2ИЬТә,AGУлЛщјУNaOH ИЬТәөДМе»э(V)№ШПөИзНјЛщКҫЈ¬ПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
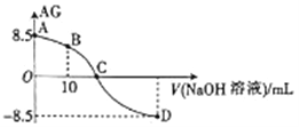
A. BөгИЬТәЦРҙжФЪc(H+)-c(OH-)=c(NO2-)-c(HNO2)
B. DөгИЬТәЦРөДpH=11.25
C. CөгКұ,јУИлNaOH ИЬТәөДМе»эОӘ20.00 mL
D. 25 ЎжКұ,HNO2 өДөзАлЖҪәвіЈКэKa=1.0ЎБ10-5.5
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝлВ(N2H4)КЗТ»ЦЦЦШТӘөД»Ҝ№ӨФӯБПЈ¬јИҝЙУГУЪЦЖТ©Ј¬УЦҝЙУГЧч»рјэИјБПЎЈ»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ТСЦӘ·ҙУҰөДИИ»ҜС§·ҪіМКҪИзПВЈә
ўЩN2H4(g)![]() N2(g)+2H2(g) ЎчH1Ј»
N2(g)+2H2(g) ЎчH1Ј»
ўЪN2(g)+3H2(g)![]() 2NH3(g) ЎчH2ЎЈ
2NH3(g) ЎчH2ЎЈ
·ҙУҰИИЎчH1 _____(МоЎ°ҙуУЪЎұ»тЎ°РЎУЪЎұ) ЎчH2ЎЈПт2 LөДәгИЭГЬұХИЭЖчЦРідИл1 mol N2H4Ј¬·ўЙъ·ҙУҰўЩЈ¬![]() ЈЁУГxұнКҫЈ©УлКұјдөД№ШПөИзНј1ЛщКҫЈ¬ФтёГОВ¶ИПВЈ¬·ҙУҰўЩөДЖҪәвіЈКэK=___________________ЎЈ
ЈЁУГxұнКҫЈ©УлКұјдөД№ШПөИзНј1ЛщКҫЈ¬ФтёГОВ¶ИПВЈ¬·ҙУҰўЩөДЖҪәвіЈКэK=___________________ЎЈ

ЈЁ2Ј©лВФЪБнТ»МхјюПВТІҝЙҙпөҪ·ЦҪвЖҪәвЈ¬Н¬КұЙъіЙБҪЦЦЖшМеЈ¬ЗТЖдЦРТ»ЦЦЖшМеДЬК№КӘИуөДәмЙ«КҜИпКФЦҪұдА¶ЎЈНј2ОӘЖҪәвМеПөЦРлВөДМе»э·ЦКэУлОВ¶ИЎўС№ЗҝөД№ШПөЎЈ
ўЩёГ·ҙУҰөД»ҜС§·ҪіМКҪОӘ________________________________________ЎЈ
ўЪp2_______ (МоЎ°ҙуУЪЎұ»тЎ°РЎУЪЎұ) p1ЎЈ
ўЫНјЦРN2H4өДЖҪәвМе»э·ЦКэЛжОВ¶ИЙэёЯ¶шҪөөНЈ¬ЖдФӯТтКЗ__________________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com