
����Ŀ���ִ�����ʹ�õ�ȼ�ϴ����ú����Һ��ʯ������ú������Ҫ�ɷ���һ����̼����������ú̿��ˮ(����)��Ӧ�Ƶã����ֳ�ˮú����
(1)д����ȡú������Ҫ��Ӧ�Ļ�ѧ����ʽ_______________��
(2)Һ��ʯ��������Ҫ�ɷ��DZ��飬����ȼ�յ��Ȼ�ѧ����ʽΪC3H8(g)��5O2(g)===3CO2(g)��4H2O(l)����H����2 220.0 kJ/mol����֪CO����ȼ�յ��Ȼ�ѧ����ʽΪCO(g)��![]() O2(g)===CO2(g)����H����282.57 kJ/mol���ԱȽ�ͬ���ʵ�����C3H8��COȼ�գ����������ı�ֵԼΪ________��
O2(g)===CO2(g)����H����282.57 kJ/mol���ԱȽ�ͬ���ʵ�����C3H8��COȼ�գ����������ı�ֵԼΪ________��
(3)��֪����ȼ�յ��Ȼ�ѧ����ʽΪ2H2(g)��O2(g)===2H2O(l)����H����571.6 kJ/mol��
�ԱȽ�ͬ�����������ͱ���ȼ�գ����������ı�ֵԼΪ________��
(4)������δ��������Դ���������������⣬�����е��ŵ���__________(������)��
���𰸡�C��H2O(g)![]() CO��H27.9��12.8��1����Դ�ḻ������ȼ�ղ���Ի�������Ⱦ
CO��H27.9��12.8��1����Դ�ḻ������ȼ�ղ���Ի�������Ⱦ
��������
��1��ú̿��ˮ�����ڸ����·�Ӧ����һ����̼����������2�������Ȼ�ѧ����ʽ������ͬ���ʵ����ı����һ����̼��ȫȼ��������̬����ʱ����������֮�ȣ���3��1mol����ȼ�շų�286kJ����������4������������ȼ�յIJ��P��Դ�����ش���
��1��ú̿��ˮ�����ڸ����·�Ӧ����һ����̼����������Ӧ����ʽΪC+H2O![]() CO+H2����2�������Ȼ�ѧ����ʽ��֪����ͬ���ʵ����ı����һ����̼��ȫȼ��������̬����ʱ����������֮��Ϊ2220.0kJmol-1��282.57kJmol-1=2220��283=7.9��1����3����H2��C3H8��������Ϊ1 g������������ı�ֵԼΪ(
CO+H2����2�������Ȼ�ѧ����ʽ��֪����ͬ���ʵ����ı����һ����̼��ȫȼ��������̬����ʱ����������֮��Ϊ2220.0kJmol-1��282.57kJmol-1=2220��283=7.9��1����3����H2��C3H8��������Ϊ1 g������������ı�ֵԼΪ(![]() ��
��![]() ��571.6 kJ��mol��1)��(
��571.6 kJ��mol��1)��(![]() ��2220 kJ��mol��1)��2.8��1����4���������п�ȼ�ԣ�ȼ�յIJ�����ˮ����Ⱦ��������ˮ��ȡ��������Դ�㣬�ʴ�Ϊ����Դ�㷺����������Ⱦ��
��2220 kJ��mol��1)��2.8��1����4���������п�ȼ�ԣ�ȼ�յIJ�����ˮ����Ⱦ��������ˮ��ȡ��������Դ�㣬�ʴ�Ϊ����Դ�㷺����������Ⱦ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڼ�����ϵ��Ʊ����ѳ�Ϊ��Ҫ�Ļ�������Ҫԭ�ϡ��Էϴ���GCS(��Ҫ�ɷ�ΪGa2O3��Cr2O3��SiO2)Ϊԭ���Ʊ��������Ĺ�����������:

(1)��������Ҫ�ɷ���______(д��ѧʽ)����ϡ��ˮ������ҺpH��3.0~3.5֮���Ŀ����________��
(2)�������ܽ�ʱ,�¶�Ӧ������40~80�棬ʵ���ҿ��Ƹ��¶�����ķ�����______���¶ȸ���80�棬�ܽ����ʼ�������ԭ����____________��
(3)���ü�ѹ�����Ŀ����_________________��
(4)����GCS�����ڴ�����ϩ��ԭһ��������������β���ŷŶԴ�������Ⱦ��д���÷�Ӧ�Ļ�ѧ����ʽ:________________��
(5)���������Ʊ����ء�ҿ�Ͳ��Ĵ���������Ч�ش�������ת��Ϊ�ױ����÷�Ӧ�Ļ�ѧ����ʽΪ________________��
(6)�����ؾ�����ȹ�����,����ʧ����[ʧ����=![]() ]���¶ȵı仯��ϵ��ͼ��ʾ��A��ʱ���������ʵĻ�ѧʽΪ_________��B����C��仯�����У����ɵ�����ΪN2O5����һ�ֵ��������ñ仯���ܷ�Ӧ����ʽΪ___________��
]���¶ȵı仯��ϵ��ͼ��ʾ��A��ʱ���������ʵĻ�ѧʽΪ_________��B����C��仯�����У����ɵ�����ΪN2O5����һ�ֵ��������ñ仯���ܷ�Ӧ����ʽΪ___________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������м��м��Լ������зǼ��Լ��ķǼ��Է�����( )
A. ������̼ B. ���Ȼ�̼ C. ˫��ˮ D. ��Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з�Ӧ���Ȼ�ѧ����ʽ
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ��H1
2 H2(g)+ O2(g) 2H2O(g) ��H2
C(s)+ O2(g) CO2(g) ��H3
��Ӧ4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)����HΪ
A. 12��H3+5��H2��2��H1 B. 2��H1��5��H2��12��H3
C. 12��H3��5��H2��2��H1 D. ��H1��5��H2��12��H3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����͵��Ҵ���أ����û����������ܼ�����200 ������ʱ���磬�Ҵ���رȼ״����Ч�ʸ߳�32���Ҹ���ȫ������ܷ�ӦΪC2H5OH��3O2===2CO2��3H2O�����ʾ����ͼ������˵������ȷ����( )

A. a��Ϊ��صĸ���
B. ��ع���ʱ��������b���ص��߾������ٵ�a��
C. ��������ĵ缫��ӦΪ4H����O2��4e��===2H2O
D. ��ع���ʱ��1 mol�Ҵ�������ʱ����6 mol����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼA��B��C�����ձ��зֱ�ʢ����ͬ���ʵ���Ũ�ȵ�ϡ���ᡣ
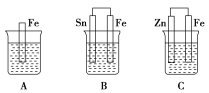
(1)A�з�Ӧ�����ӷ���ʽΪ_____________________________________��
(2)B��Sn���ĵ缫��ӦʽΪ___________________________________��
(3)C�б���Ӧ���Ľ�����________���ܷ�Ӧ�Ļ�ѧ����ʽΪ_________���Ƚ�A��B��C������Ӧ�����ʣ��ɿ쵽����˳��Ϊ____________(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��Ӧ2A![]() B��D�����ֲ�ͬ�����½��У�B��D����ʼŨ��Ϊ0����Ӧ��A��Ũ��(mol��L��1)�淴Ӧʱ��(min)�ı仯������±���
B��D�����ֲ�ͬ�����½��У�B��D����ʼŨ��Ϊ0����Ӧ��A��Ũ��(mol��L��1)�淴Ӧʱ��(min)�ı仯������±���
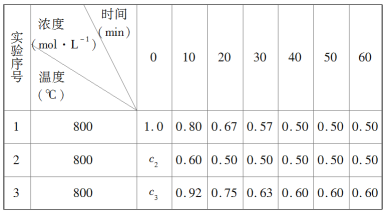
�����������ݣ����������գ�
(1)ʵ��1�У�10��20 min��A�ķ�Ӧ����Ϊ________mol��L��1��min��1��
(2)ʵ��2�У�c2��________����Ӧ��20 minʱ�ﵽƽ�⣬���Ʋ�ʵ��2�л�������������________________________________��
(3)��10��20 min��ʵ��3��A�ķ�Ӧ����Ϊv3��ʵ��1��A�ķ�Ӧ����Ϊv1����v3________v1(�>����������<��)����c3________1.0(�>����������<��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӵ��������Ṥ���У�����Ӧ��450�沢�д��������½��У�![]()
![]()
��1�����º��������£�������˵���˷�Ӧ�Ѵ�ƽ�����________��
��![]()
�������������ƽ��Ħ����������ʱ����仯
��������������ܶȲ���ʱ����仯
�����������������������ʱ����仯
��2�������йظ÷�Ӧ���ʵ������У���ȷ����_________��
a. �����¶ȿ����������Ӱٷ������ӿ췴Ӧ����
b. ʹ�ô�����߶��������ת����
c. ʹ�ô�������ʹ��Ӧ�����ƽ���������ߣ��ӿ췴Ӧ����
d. ��С�����������ѹǿ�����������Ӱٷ����������Լӿ췴Ӧ����
��3����ͼ��ʾ��![]() ��
��![]() ����2L�ܱ������У�����������һ��ʱ��
����2L�ܱ������У�����������һ��ʱ�� ![]() ��ƽ��ת����a��X�ı仯��ϵ��
��ƽ��ת����a��X�ı仯��ϵ�� ![]() ����ѹǿ���¶ȡ�X��������������___________��A��Ӧ������ƽ�ⳣ��K=___________��
����ѹǿ���¶ȡ�X��������������___________��A��Ӧ������ƽ�ⳣ��K=___________��

��4��һ���¶��£����ݻ�������ܱ������г���![]() ��
��![]() ����ƽ��ʱ
����ƽ��ʱ![]() ���������Ϊa%��������������ʱ�������������������Ϊ��ʼ���ʣ�ƽ���
���������Ϊa%��������������ʱ�������������������Ϊ��ʼ���ʣ�ƽ���![]() �����������Ϊa%����__________��
�����������Ϊa%����__________��
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
��5��![]() ��
��![]() ��Ӧ����
��Ӧ����![]() ��
�� ![]() ���뷽��ʽΪ___________����
���뷽��ʽΪ___________����![]() ��Һ�м���
��Һ�м���![]() ���壬�����ƽ����__________��Ӧ�����ƶ���
���壬�����ƽ����__________��Ӧ�����ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ֹѪ��Ч�������ڶ�����ҩ�У���ṹ��ʽ����ͼ������˵������ȷ����
![]()
A. ��������Է���ȡ�����ӳɡ��������������Ӿ۷�Ӧ
B. 1mol �������������5 mol H2��Ӧ
C. ���������������ԭ�ӿ��ܹ���
D. �佺�ķ���ʽΪC17H16O4����һ�������¿�ˮ�����ɿ������һ��һԪ��A����A �ķ���ʽΪC8H10O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com