
����Ŀ��ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
��ʵ��ԭ����![]() __________
__________
��ʵ�����ݼ���¼��
ʵ���� | �����£��Թ��������Լ���������/mL | ��������Һ��ɫ������ɫ����ʱ��/min | |||
|
|
|
ϡ���� | ||
1 | 3.0 | 2.0 | 1.0 | 2.0 | 4.0 |
2 | 2.0 | 3.0 | 1.0 | 2.0 | 5.2 |
3 | 1.0 | 4.0 | 1.0 | 2.0 | 6.4 |
��ش�
��1�������ϱ��е�ʵ�����ݣ����Եõ��Ľ�����___________��
��2������ʵ��1�����ݼ��㣬��![]() ��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ��
��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ�� ![]() _____________
_____________
��3����С��ͬѧ���ݾ��������![]() ��ʱ��仯���Ƶ�ʾ��ͼ����ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������
��ʱ��仯���Ƶ�ʾ��ͼ����ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������![]() ��ʱ��仯������Ӧ��ͼ2��ʾ����С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��裬����������ʵ��̽����
��ʱ��仯������Ӧ��ͼ2��ʾ����С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��裬����������ʵ��̽����
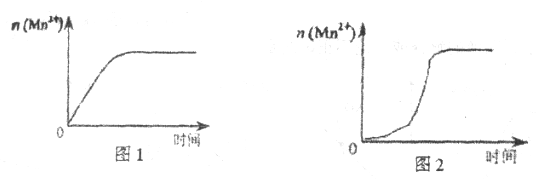
�ٸ�С��ͬѧ����ļ�����____________��
�����������С��ͬѧ���ʵ�鷽��������д���пհס�
ʵ���� | �����£��Թ��������Լ���������/mL | �����Թ��м����������� | ��������Һ��ɫ������ɫ����ʱ��/min | |||
|
|
|
ϡ���� | |||
4 | 3��0 | 2��0 | 1��0 | 2��0 | ____ | t |
������С��ͬѧ����ļ��������Ӧ�۲쵽��������______________��
���𰸡� ![]() ����������ͬʱ������
����������ͬʱ������![]() Ũ�ȣ���Ӧ��Ũ�ȣ�����Ӧ��������
Ũ�ȣ���Ӧ��Ũ�ȣ�����Ӧ�������� ![]() �������е�
�������е�![]() Ϊ�÷�Ӧ�Ĵ�������
Ϊ�÷�Ӧ�Ĵ�������![]() �Ը÷�Ӧ�д����ã�
�Ը÷�Ӧ�д����ã� ![]() ��ʵ��1�Ƚϣ���Һ��ɫ����ʱ���
��ʵ��1�Ƚϣ���Һ��ɫ����ʱ���
����������ʵ��ԭ����������ԭ��Ӧ��Ҫ���������غ�ͻ��ϼ������غ㣬��Ӧ��ԭ��Ϊ2KMnO4+5H2C2O4+3H2SO4�TK2SO4+2MnSO4+10CO2��+8H2O���ʴ�Ϊ��2KMnO4+5H2C2O4+3H2SO4�TK2SO4+2MnSO4+10CO2��+8H2O��
(1)�ӱ������ݿ�֪�ı��������H2C2O4Ũ�ȣ�����������ͬʱ������H2C2O4Ũ�ȣ���Ӧ�������ʴ�Ϊ������������ͬʱ������H2C2O4Ũ������Ӧ��������
(2)��������ʵ���Ϊ��0.6molL-1��0.003L=0.0018mol��������ص����ʵ���Ϊ��0.2molL-1��0.001L=0.0002mol�����������ص����ʵ���֮��Ϊ��0.0018mol��0.0002mol=9��1����Ȼ������������������ȫ��Ӧ����Ϻ���Һ�и�����ص�Ũ��Ϊ�� ![]() =0.025mol/L�����ʱ����ƽ����Ӧ����v(KMnO4)=
=0.025mol/L�����ʱ����ƽ����Ӧ����v(KMnO4)= ![]() =6.25��10-3mol/(Lmin)���ʴ�Ϊ��6.25��10-3mol/(Lmin)��
=6.25��10-3mol/(Lmin)���ʴ�Ϊ��6.25��10-3mol/(Lmin)��
(3)����ͼ�ҿ�֪��Ӧ��ʼ����������ıȽϿ죬˵���������е�MnSO4(��Mn2+)Ϊ�÷�Ӧ�Ĵ������ʴ�Ϊ���������е�MnSO4Ϊ�÷�Ӧ�Ĵ���(��Mn2+�Ը÷�Ӧ�д�����)��
����ʵ��1���Ա�ʵ�飬�����������̵�����ͬ����������������ͬ�����Լ������������ΪMnSO4���ʴ�Ϊ��MnSO4��
������С��ͬѧ����ļ����������Ӧ���ʼӿ죬��Һ��ɫ��ʱ��С��4min���Ӷ�˵��Mn2+�Ǵ������ʴ�Ϊ����ʵ��1�Ƚϣ���Һ��ɫ����ʱ�����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Գ�����![]() ��
��![]() ��Һ��������������ȷ����
��Һ��������������ȷ����
A. ![]()
B. ��������![]() �����
����� ![]() ����
����
C. ����Һ����![]() �������
�������![]() ��
��![]()
D. ������![]() ��
��![]() ��Һ��Ϻ�������Һ������
��Һ��Ϻ�������Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ����ǿ������Һ�У��ܴ���������ǣ� ��
A.Na+��CO32����Ca2+��NO3��
B.Na+��NO3����Al3+��Cl��
C.K+��SO42����Cl����Cu2+
D.Ba2+��Cl����K+��SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������NO2��ƽ������������ɫ���������ɫ��dz��ָʾ���ȹ��̺����ȹ��̡�

�ٰ�ͼ��ʾ��ʵ��װ�����Ӻá�
������ձ���ˮ��Ͷ��һ������CaO���壬���ձ��е�NO2ƽ��������ĺ���ɫ��������ձ��м���NH4NO3���壬��ʱ�ձ���NO2ƽ����������ɫ��dz��
�ش��������⣺
(1)CaO��ˮ��Ӧ�Ļ�ѧ����ʽΪ_______________________���÷�ӦΪ________(����ȷ�Ӧ�����ȷ�Ӧ��)��CaO��H2O��������________(����ڡ����ڡ�)Ca(OH)2��������
(2)NH4NO3��������ˮ��ˮ���¶�________(����ߡ����͡�)��NH4NO3����ˮ________(��ǡ����ǡ�)���ȷ�Ӧ��
(3)��������֪��NO2��ƽ�������д��ڵĿ��淴ӦΪ2NO2(g)![]() N2O4(g)����֪NO2Ϊ����ɫ��N2O4Ϊ��ɫ�����ʵ��֪�����¶�����ʱ��ԭƽ��________(�δ���ƻ��������ƶ���)����ʱ��Ӧ����________(�������С�����ޱ仯��)������������ɫ���ٸı�________(��ܡ����ܡ�)֤����Ӧ�Ѵ�ƽ�⡣
N2O4(g)����֪NO2Ϊ����ɫ��N2O4Ϊ��ɫ�����ʵ��֪�����¶�����ʱ��ԭƽ��________(�δ���ƻ��������ƶ���)����ʱ��Ӧ����________(�������С�����ޱ仯��)������������ɫ���ٸı�________(��ܡ����ܡ�)֤����Ӧ�Ѵ�ƽ�⡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ����ı�ʾ��ȷ����( )
A. ��������ģ�ͣ�![]() B. �����ӵĽṹʾ��ͼ��
B. �����ӵĽṹʾ��ͼ��![]()
C. �����Ľṹʽ����N��N�� D. �Ȼ���ĵ���ʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������У��Ȳ�����NaOH��Һ������Ӧ���ֲ��������CCl4��Һ��Ӧ��Ҳ����ʹ����KMnO4��Һ��ɫ���ǣ� ��
A.����B.�Ҵ�C.����D.��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������У�����֤������������ʵ���
A. 0.1mol��L������Һ��c��H+��ԼΪ1��10-3mol��L
B. ��������ˮ���κα�������
C. 10mL 1mol��L����ǡ����10mL 1mol��L NaOH��Һ��ȫ��Ӧ
D. ������Һ�ĵ����Ա�������Һ����
���𰸡�A
��������0.1mol��L������Һ��c��H+��ԼΪ1��10-3mol��L��˵������ֻ������һ���֣�������������ʣ�ѡ��A��ȷ����������ˮ���κα��������Ǵ�����������ʣ���������ʵ�ǿ���أ�ѡ��B����10mL 1mol��L��һԪ�ᣨ����ǿ��������ǡ����10mL 1mol��L NaOH��Һ��ȫ��Ӧ������ѡ��C������Ϊû��˵��Ũ�ȵĹ�ϵ�����Դ�����Һ�ĵ����Ա�������Һ������������˵��������������ʣ�ѡ��D����
�㾦��֤��һ��һԪ��HA��������ʵķ�����Ҫ�У�
���0.1mol/L����Һ�����������Ũ��С��0.1mol/L�����߲��pH��1��
��NaA����Һ������ԣ��õ�����Һ�Լ��ԡ�
�����ͬŨ�ȵ�HA��HCl��Һ�����HA�ĵ����Խϲ
�����͡���ѡ��
��������
16
����Ŀ�����б�ʾ��ѧ���̵Ļ�ѧ������д��ȷ����
A. BaSO4Ͷ��ˮ�к����ij����ܽ�ƽ��:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. AlCl3��Һ��NaAlO2��Һ���:A13++A1O2-+3H2O![]() 2Al(OH)3��
2Al(OH)3��
C. HCO3-�ĵ���:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Na2SO3��ˮ��:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5L 1mol/L FeCl3��Һ��0.2L 1mol/L KCl��Һ�е�Cl�������ʵ���Ũ��֮�ȣ� ��
A.5��2
B.3��1
C.15��2
D.1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ���칹���������ȷ����
A. ��Է���������ͬ���ṹ��ͬ�Ļ����ﻥ��Ϊͬ���칹��
B. ��ѧʽ��ͬ���ṹ��ͬ�Ļ����ﻥ��Ϊͬ���칹��
C. ͬ���칹��֮�����ڷ��������ͬ���������ǵ�������ͬ
D. ֻ���������л���֮�����ͬ���칹����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com