
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
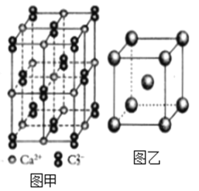
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
【答案】第四周期 Ⅷ族 [Ar]3d5或1s22s22p63s23p63d5 AB K<C<O<N sp sp2 2:1 4 分子 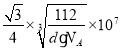
【解析】
(1)Fe的原子序数是26,根据构造原理知Fe的核外电子排布式为[Ar]3d64s2,据此确定其在周期表的位置;基态Fe失去4s上2个电子和3d轨道上1个电子即为Fe3+;
(2)根据化学键的类型和特点解答,注意氢键是分子间作用力,不是化学键;
(3)①KCNO由K、C.N、O四种元素组成,K为金属、容易失去电子,第一电离能最小,C、N、O位于第二周期,但N的p轨道是半充满状态、能量最低;
②丙烯腈(H2C=CHC≡N)分子中碳原子VSEPR构型有两种形式:平面三角形和直线形,杂化方式也有sp、sp2两种形式,其中C=C含有1个σ键和1个π键、C≡N含有1个σ键和2个π键,CH都是σ键,确定分子中σ键和π键数目,再求出比值;
(4)1个Ca2+周围距离最近且等距离的C22应位于同一平面,注意使晶胞沿一个方向拉长的特点;
(5)Fe(CO)5的熔点、沸点均不高,类似于分子晶体的特点;
(6)Fe单质的晶胞模型为体心立方堆积,晶胞的原子均摊数为8×![]() +1=2,晶胞的质量为
+1=2,晶胞的质量为![]() g,晶胞体积V=
g,晶胞体积V=![]() cm3、边长a=
cm3、边长a=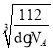 cm,根据Fe原子半径r与晶胞边长a关系求出r。
cm,根据Fe原子半径r与晶胞边长a关系求出r。
(1)Fe的原子序数是26,根据构造原理知Fe的核外电子排布式为[Ar]3d64s2,位于第四周期Ⅷ族据;基态Fe失去4s上2个电子和3d轨道上1个电子即为Fe3+,所以基态Fe3+核外电子排布式为) [Ar]3d5或1s22s22p63s23p63d5故答案为:第四周期Ⅷ族,[Ar]3d5或[Ar]3d5或1s22s22p63s23p63d5;
(2)[Fe(CN)6]3是阴离子,是配合物的内界,含有配位键和极性共价键,金属键存在于金属晶体中,氢键是分子间作用力,不是化学键,故选AB;故答案为:AB;
(3)①KCNO中K为金属、容易失去电子,第一电离能最小,C、N、O位于第二周期,但N的p轨道是半充满状态、能量最低,所以第一电离能大于O,C的非金属性小于O,第一电离能小于O,所以第一电离能由小到大排序为K<C<O<N;故答案为:K<C<O<N;
②丙烯腈(H2C=CHC≡N)分子中碳原子VSEPR构型有两种形式:平面三角形和直线形,杂化方式也有sp、sp2两种形式,其中C=C含有1个σ键和1个π键、C≡N含有1个σ键和2个π键,CH都是σ键,所以分子中σ键和π键数目分别为6、3,σ键和π键数目之比为6:3=2:1;故答案为:sp、sp2;2:1;
(4)依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22不是6个,而是4个,故答案为:4;
(5)根据Fe(CO)5的熔点、沸点均不高的特点,可推知Fe(CO)5为分子晶体;故答案为:分子;
(6)Fe单质的晶胞模型为体心立方堆积,晶胞的原子均摊数为8×![]() +1=2,晶胞的质量为
+1=2,晶胞的质量为![]() g,晶胞体积V=
g,晶胞体积V=![]() cm3、边长a=
cm3、边长a=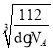 cm,Fe原子半径r与晶胞边长a关系为4r=
cm,Fe原子半径r与晶胞边长a关系为4r=![]() a,所以r=
a,所以r=![]() a=
a=![]()
![]()
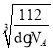 cm=
cm=![]()
![]()
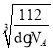 ×107nm;故答案为:
×107nm;故答案为:![]()
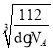 ×107。
×107。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
A.Fe分别与氯气和稀盐酸反应所得氯化物相同
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入![]() 固体,铜粉仍不溶解
固体,铜粉仍不溶解
C.向![]() 溶液中滴加氨水,产生白色沉淀;再加入过量
溶液中滴加氨水,产生白色沉淀;再加入过量![]() 溶液,沉淀消失
溶液,沉淀消失
D.![]() 、
、![]() 组成元素相同,阴阳离子个数比相同,与
组成元素相同,阴阳离子个数比相同,与![]() 反应产物也相同
反应产物也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁带能在CO2中燃烧,生成氧化镁和单质碳。请完成下列填空:
(1)碳元素形成的单质有金刚石、石墨、足球烯等。金刚石的熔点远高于足球烯的原因是_______。
(2)氧化镁的电子式为_______,CO2的结构式为______。与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为______,其1个原子中能量最高的电子有______个。
(3)一定条件下,在容积恒为2.0L的容器中,Fe和CO2发生如下反应:CO2(g)+Fe(s)![]() FeO(s)+CO(g),若起始时向容器中加入1molCO2,5.0min后,容器内气体的相对平均分子量为32,则n(CO2):n(CO)之比为_______,这段时间内用CO2表示的速率v(CO2)=_______。
FeO(s)+CO(g),若起始时向容器中加入1molCO2,5.0min后,容器内气体的相对平均分子量为32,则n(CO2):n(CO)之比为_______,这段时间内用CO2表示的速率v(CO2)=_______。
(4)下列说法错误的是_______。
a.当混合气体的密度不变时说明反应达到了平衡
b.混合气体的平均相对分子质量不变时说明反应达到了平衡
c.平衡后移除二氧化碳时,正反应速率一直减小直至建立新的平衡
d.平衡后缩小容器的体积,正逆反应速率不变,平衡不移动
(5)保持温度不变的情况下,待反应达到平衡后再充入一定量的二氧化碳,平衡向______移动(选填“正向”、“逆向”、或“不”),二氧化碳的转化率_____(填“增大”,“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________形象化描述。在基态原子中,核外存在______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_____________。
(3)CS2分子中,共价键的类型有_____________,C原子的杂化轨道类型是_______,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______________。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
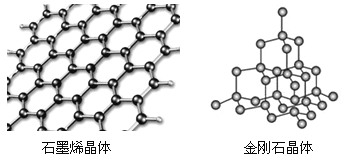
①在石墨烯晶体中,每个C原子连接_____个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________个六元环,六元环中最多有________个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向100mL0.1mol/LNH4HSO4溶液中逐滴滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设溶液的体积有加和性)。下列分析正确的是
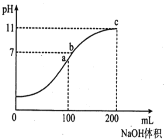
A.ab段和bc段发生的离子反应一定不同
B.水的电离程度最大的是c点
C.b点溶液中各离子浓度由大到小的排列顺序是:C(Na+)>C(NH4+)>C(SO42-)>C(H+)=C(OH-)
D.NH4+的水解平衡常数Kh的数量级为10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物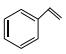 (甲)、
(甲)、![]() (乙)、
(乙)、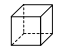 (丙)的分子式均为
(丙)的分子式均为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A. 甲的同分异构体只有乙和丙两种
B. 甲、乙、丙的一氯代物种数最少的是丙
C. 甲、乙、丙均可与溴的四氯化碳溶液反应
D. 甲中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
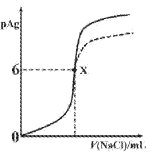
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中浓度关系正确的是( )
A. 小苏打溶液中:c(Na+)+c(H+)=c(HCO)+c(CO![]() )+c(OH-)
)+c(OH-)
B. CH3COONa溶液中:c(CH3COO-)>c(Na+)
C. 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D. 0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合处理工业“三废”,有利于保护环境、节约资源。反应 2NO(g)+2CO(g)2CO2(g)+N2(g),可减少汽车尾气中污染物的排放,在 2L 密闭容器中发生该反应时,n(CO2)随温度 T 和时间 t 的变化曲线如图所示。

(1)该反应的平衡常数表达式为K=______,若升高温度,平衡常数 K 值______(填“增加”“减小”或“不变”),说明理由______;
(2)在 T2温度下, 0~2s 内的平均反应速率 v(N2)=______;
(3)工业废水的处理方法有很多,使用 Fe2(SO4)3 处理废水,酸性废水中的悬浮物很难沉降除去,结合离子方程式用平衡移动原理解释原因______,干法制备多功能水处理剂高铁酸钠(Na2FeO4)的反应原理为:2FeSO4+6Na2O2→2Na2FeO4+Na2O+2Na2SO4+O2↑,该反应的氧化剂为______;
(4)采用氨碱法生产纯碱会产生大量的副产品______,用化学方程式表示产生副产品的原因______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com