
【题目】综合处理工业“三废”,有利于保护环境、节约资源。反应 2NO(g)+2CO(g)2CO2(g)+N2(g),可减少汽车尾气中污染物的排放,在 2L 密闭容器中发生该反应时,n(CO2)随温度 T 和时间 t 的变化曲线如图所示。

(1)该反应的平衡常数表达式为K=______,若升高温度,平衡常数 K 值______(填“增加”“减小”或“不变”),说明理由______;
(2)在 T2温度下, 0~2s 内的平均反应速率 v(N2)=______;
(3)工业废水的处理方法有很多,使用 Fe2(SO4)3 处理废水,酸性废水中的悬浮物很难沉降除去,结合离子方程式用平衡移动原理解释原因______,干法制备多功能水处理剂高铁酸钠(Na2FeO4)的反应原理为:2FeSO4+6Na2O2→2Na2FeO4+Na2O+2Na2SO4+O2↑,该反应的氧化剂为______;
(4)采用氨碱法生产纯碱会产生大量的副产品______,用化学方程式表示产生副产品的原因______。
【答案】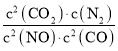 减小 由图速率变化推断T1>T2,由平衡时n(CO2)变化推断平衡逆向移动,正向为放热反应,所以温度升高,平衡常数K值减小 0.0125mol/(Ls) Fe3++3H2OFe(OH)3+3H+,废水中的酸(H+)抑制了Fe3+的水解平衡,减少了Fe(OH)3胶体的生成,降低了吸附能力 Na2O2 CaCl2 Ca(OH)2+2NH4Cl=CaCl2+NH3↑+2H2O
减小 由图速率变化推断T1>T2,由平衡时n(CO2)变化推断平衡逆向移动,正向为放热反应,所以温度升高,平衡常数K值减小 0.0125mol/(Ls) Fe3++3H2OFe(OH)3+3H+,废水中的酸(H+)抑制了Fe3+的水解平衡,减少了Fe(OH)3胶体的生成,降低了吸附能力 Na2O2 CaCl2 Ca(OH)2+2NH4Cl=CaCl2+NH3↑+2H2O
【解析】
(1)反应的平衡常数等于生成物浓度幂积与反应物浓度幂积之比;根据速率变化或“先拐先平,数值大”规则可知T1>T2,由图可知,升高温度,n(CO2)减小;
(2)根据v=![]() =
=![]() 计算v(CO2),再根据反应计量关系计算v(N2);
计算v(CO2),再根据反应计量关系计算v(N2);
(3)Fe2(SO4)3水解的离子反应为Fe3++3H2OFe(OH)3+3H+,酸性废水中的H+会导致Fe2(SO4)3不能形成胶体或者胶体非常少;氧化还原反应中氧化剂发生还原反应、元素的化合价降低,据此分析解答;
(4)氨碱法工艺中产生大量CaCl2的化学方程式为:2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O,据此分析解答。
2NH3↑+CaCl2+2H2O,据此分析解答。
![]() (1)反应2NO(g)+2CO(g)2CO2(g)+N2(g)的平衡常数K=
(1)反应2NO(g)+2CO(g)2CO2(g)+N2(g)的平衡常数K=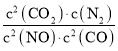 ,根据速率变化或“先拐先平,数值大”规则可知T1>T2,由n(CO2)随温度T和时间t的变化曲线图可知,升高温度,n(CO2)减小,即升高温度,平衡逆向移动,正反应为放热反应,所以平衡常数K值减小,故答案为:
,根据速率变化或“先拐先平,数值大”规则可知T1>T2,由n(CO2)随温度T和时间t的变化曲线图可知,升高温度,n(CO2)减小,即升高温度,平衡逆向移动,正反应为放热反应,所以平衡常数K值减小,故答案为: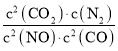 ;减小;由图速率变化推断T1>T2,由平衡时n(CO2)变化推断平衡逆向移动,正向为放热反应,所以温度升高,平衡常数K值减小;
;减小;由图速率变化推断T1>T2,由平衡时n(CO2)变化推断平衡逆向移动,正向为放热反应,所以温度升高,平衡常数K值减小;
(2)由图可知,v(CO2)=![]() =
=![]() =0.025mol/(Ls),反应为2NO(g)+2CO(g)2CO2(g)+N2(g),则v(N2)=v(CO2)=×0.025mol/(Ls)=0.0125mol/(Ls),故答案为:0.0125mol/(Ls);
=0.025mol/(Ls),反应为2NO(g)+2CO(g)2CO2(g)+N2(g),则v(N2)=v(CO2)=×0.025mol/(Ls)=0.0125mol/(Ls),故答案为:0.0125mol/(Ls);
(3)Fe2(SO4)3中Fe3+水解的离子方程式为Fe3++3H2OFe(OH)3+3H+,酸性废水中H+抑制了Fe3+的水解平衡,减少了Fe(OH)3胶体的生成,降低了吸附能力,因此不能吸附悬浮物沉降而除去;反应2FeSO4+6Na2O2→2Na2FeO4+Na2O+2Na2SO4+O2↑中,Fe的化合价由+2→+6,发生氧化反应,即FeSO4为还原剂,Na2O2中O的化合价-1→-2或0,所以Na2O2既是氧化剂,又是还原剂,故答案为:Fe3++3H2OFe(OH)3+3H+,废水中的酸(H+)抑制了Fe3+的水解平衡,减少了Fe(OH)3胶体的生成,降低了吸附能力;Na2O2;
(4)氨碱法工艺中,为提高氨气的利用率,常在母液中加入生石灰CaO,反应为CaO+H2O=Ca(OH)2,加热条件下Ca(OH)2和NH4Cl![]() 2NH3↑+CaCl2+2H2O,同时得到大量副产品CaCl2,故答案为:CaCl2;2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O,同时得到大量副产品CaCl2,故答案为:CaCl2;2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O。
2NH3↑+CaCl2+2H2O。


科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
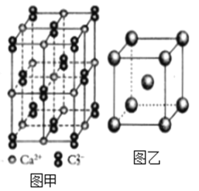
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是( )
A.![]() 是酸性氧化物,不溶于水,也不能与任何酸发生反应
是酸性氧化物,不溶于水,也不能与任何酸发生反应
B.![]() 、
、![]() 组成元素虽然相同,但与
组成元素虽然相同,但与![]() 、
、![]() 等反应的产物不完全相同
等反应的产物不完全相同
C.CO、![]() 、NO、
、NO、![]() 都是对大气产生污染的气体,他们在空气中都能稳定存在
都是对大气产生污染的气体,他们在空气中都能稳定存在
D.浓硫酸可用于干燥氢气、氯化氢、碘化氢等气体,但不能干燥氨气、二氧化氮气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温时,a mol/L醋酸与0.1mol/LNaOH溶液等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=___________ (用含a的代数式表示)
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
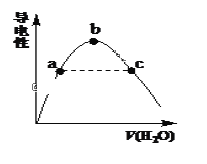
①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是_____(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李克强总理在《2018年国务院政府工作报告》中强调“今年二氧化硫、氮氧化物排放量要下降3%。”研究烟气的脱硝(除NOx)、脱硫(除SO2)有着积极的环保意义。
Ⅰ.车排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。

(1)图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是_______(填“a”或“b”)
(2)在a曲线所示反应中,0~10min内,CO的平均反应速率v(CO)=_________;T℃时,该反应的化学平衡常数K=__________;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将移动_____________(填“向左”、“向右”或“不”)
(3)15min时, n (NO)发生图中所示变化,则改变的条件可能是_______(填序号)
A .充入少量COB .将N2液化移出体系C .升高温度D .加入催化剂
(4)Ⅱ. 已知有下列反应:
①5O2(g)+ 4NH3(g)![]() 6H2O(g)+ 4NO(g) △H1
6H2O(g)+ 4NO(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③2NO(g)+ O2(g)![]() 2NO2(g) △H3
2NO2(g) △H3
若在高效催化剂作用下可发生8NH3(g)+ 6NO2(g)![]() 7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=_________(用△H1,△H2,△H3表示),△S__________0。
7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=_________(用△H1,△H2,△H3表示),△S__________0。
(5)某温度下,向某恒容密闭容器中充入一定量的NH3和NO2, 按照(4)的原理模拟污染物的处理。若容器中观察到________________(填序号),可判断该反应达到平衡状态
A .混合气体颜色不再改变
B .混合气体的密度不再改变
C .混合气体摩尔质量不再改变
D .NH3和NO2的物质的量之比不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.2mol/LKMnO4酸性溶液0.1L与一定量pH=3的草酸(HOOC—COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molHOOC—COOH含共用电子对数目为0.9NA
B.当1molKMnO4被还原时,强酸提供的H+数目为NA
C.pH=3的草酸溶液含有H+数目为0.001NA
D.该反应释放CO2分子数目为![]() NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
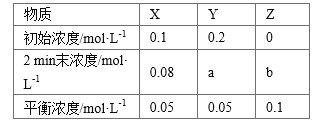
下列说法正确的是
A. 平衡时,X的转化率为20%
B. t ℃时,该反应的平衡常数为40
C. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D. 前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )

A.原子半径大小比较为D>C>B>A
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC32-、A2C42-
D.A、B、C、D的单质常温下均不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答:
(1)常温下,pH=2的醋酸和pH=12的氢氧化钠等体积混合,混合后溶液呈_____性
(2)25℃时,柠檬水的pH是3,其中氢氧根离子浓度是_______mol/L
(3)已知下列反应:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1= -akJ/mol
②C(s)+O2(g)=CO2(g) △H2= -bkJ/mol
则反应2C(s)+2H2O(l) =CH3COOH(l)的反应热为△H=_____________kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com