
【题目】(1)已知常温时,a mol/L醋酸与0.1mol/LNaOH溶液等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=___________ (用含a的代数式表示)
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
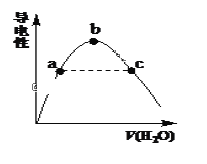
①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是_____(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________
【答案】10-6 (a-0.1) c>b>a > a<d<c<b ClO﹣+H2O+CO2=HCO3﹣+HClO
【解析】
(1)CH3COONa的水解平衡常数Kh= 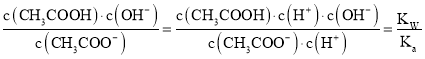 ,由此求解;
,由此求解;
(2)①溶液体积越大,醋酸电离程度越大;
②25℃时,铵盐溶液pH=7,则溶液中存在c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(NH4+),所以两点溶液中c(CH3COO-)越大则该点溶液中的c(NH4+)越大;
(3)①弱酸的电离平衡常数越大,其酸性越强,其酸根的水解程度越弱;
②次氯酸酸性大于碳酸氢根离子,反应生成碳酸氢钠和次氯酸。
(1)由电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,所以c(CH3COO-)=c(Na+)=0.05mol/L,所以Ka=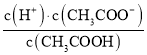 =
= ,而CH3COONa的水解平衡常数Kh=
,而CH3COONa的水解平衡常数Kh=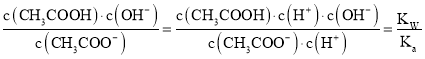 =
=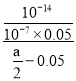 =10-6(a-0.1);
=10-6(a-0.1);
(2)①溶液体积越大,醋酸电离程度越大,根据图知,溶液体积:a<b<c,则醋酸电离程度:c>b>a;
②25℃时,铵盐溶液pH=7,则溶液中存在c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(NH4+),所以两点溶液中c(CH3COO-)越大则该点溶液中的c(NH4+)越大,溶液中c(CH3COO-):a>c,则c(NH4+):a>c,所以a点溶液中的c(CH3COO-)>c点溶液中的c(NH4+);
(3)①据电离平衡常数可知,酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO>HCO3-,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,则pH由小到大排列顺序是a<d<c<b;
②酸性:HClO>HCO3-,向次氯酸钠溶液中通入少量二氧化碳,反应生成碳酸氢根离子,该反应的离子方程式为:ClO-+H2O+CO2=HCO3-+HClO。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________形象化描述。在基态原子中,核外存在______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_____________。
(3)CS2分子中,共价键的类型有_____________,C原子的杂化轨道类型是_______,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______________。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
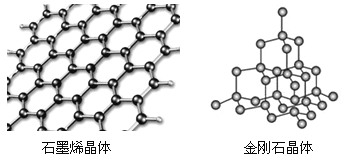
①在石墨烯晶体中,每个C原子连接_____个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________个六元环,六元环中最多有________个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中浓度关系正确的是( )
A. 小苏打溶液中:c(Na+)+c(H+)=c(HCO)+c(CO![]() )+c(OH-)
)+c(OH-)
B. CH3COONa溶液中:c(CH3COO-)>c(Na+)
C. 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D. 0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能
B.向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动
C.将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深,这一事实可以用勒夏特列原理解释
D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.2 g 铜和镁组成的混合物加入250 mL4.0 mol L-1的稀硝酸中,固体完全溶解,生成的气体只有NO。向所得溶液中加入1.0 L NaOH溶液,此时金属离子恰好沉淀完全,沉淀质量为25.4 g,下列说法不正确的是
A. 原固体混合物中,Cu和Mg的物质的量之比为2:1
B. 氢氧化钠溶液的浓度为0.8 mol·L-1
C. 固体溶解后的溶液中硝酸的物质的量为0.1mol
D. 生成的NO气体在标况下的体积为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用如图装置研究电化学原理,下列说法错误的是( )
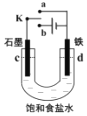
A.K 与a 连接,则铁电极会加速锈蚀,发生的电极反应为Fe-2e-→Fe2+
B.K 与a 连接,则该装置能将化学能转变为电能
C.K 与 b 连接,则该装置铁电极的电极反应 2H++2e-→H2↑
D.K 与b 连接,则铁电极被保护,该方法叫牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合处理工业“三废”,有利于保护环境、节约资源。反应 2NO(g)+2CO(g)2CO2(g)+N2(g),可减少汽车尾气中污染物的排放,在 2L 密闭容器中发生该反应时,n(CO2)随温度 T 和时间 t 的变化曲线如图所示。

(1)该反应的平衡常数表达式为K=______,若升高温度,平衡常数 K 值______(填“增加”“减小”或“不变”),说明理由______;
(2)在 T2温度下, 0~2s 内的平均反应速率 v(N2)=______;
(3)工业废水的处理方法有很多,使用 Fe2(SO4)3 处理废水,酸性废水中的悬浮物很难沉降除去,结合离子方程式用平衡移动原理解释原因______,干法制备多功能水处理剂高铁酸钠(Na2FeO4)的反应原理为:2FeSO4+6Na2O2→2Na2FeO4+Na2O+2Na2SO4+O2↑,该反应的氧化剂为______;
(4)采用氨碱法生产纯碱会产生大量的副产品______,用化学方程式表示产生副产品的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A.该盐酸的物质的量浓度为4.0mol·L-1
B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2:1
C.生成的H2S气体在标准状况下的体积为8.96L
D.该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.A物质与C物质的反应速率之比为1∶2
B.单位时间内消耗a mol A,同时消耗3a mol C
C.容器内的压强不再变化
D.混合气体的物质的量不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com