
【题目】某小组利用如图装置研究电化学原理,下列说法错误的是( )
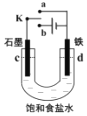
A.K 与a 连接,则铁电极会加速锈蚀,发生的电极反应为Fe-2e-→Fe2+
B.K 与a 连接,则该装置能将化学能转变为电能
C.K 与 b 连接,则该装置铁电极的电极反应 2H++2e-→H2↑
D.K 与b 连接,则铁电极被保护,该方法叫牺牲阳极的阴极保护法
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.工业上N2与H2合成NH3,往往需要使用催化剂
B.向1.50mol/L的硝酸铵溶液中加入少量氨水至中性,水的电离程度减小
C.密闭容器中2molCO与1molH2O(g)充分反应达平衡后,增大压强CO的反应速率加快
D.SO2与O2催化氧化成SO3是一个放热过程,450℃左右的温度比室温更有利于SO3生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理] 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
[实验内容及记录]
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=_____________________________。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设。并继续进行实验探究。
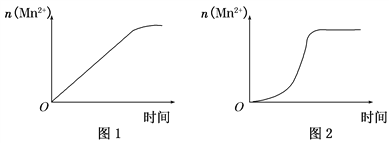
①该小组同学提出的假设是____________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | ________ | t |
③若该小组同学提出的假设成立,应观察到的现象是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,
时,![]()
![]() 和水蒸气的混合气体与过量的
和水蒸气的混合气体与过量的![]() 充分反应后,固体质量增加了
充分反应后,固体质量增加了![]() ,再将反应后剩余固体冷却后加入含有
,再将反应后剩余固体冷却后加入含有![]() 、
、![]() 、
、![]() 、
、![]() 等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是( )
等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是( )
A.原混合气体的平均摩尔质量为![]()
B.混合气体与![]() 反应过程中电子转移的物质的量为
反应过程中电子转移的物质的量为![]()
C.溶液中![]() 的物质的量浓度基本保持不变
的物质的量浓度基本保持不变
D.溶液中![]() 的物质的量浓度减小,
的物质的量浓度减小,![]() 的物质的量浓度增大,但是
的物质的量浓度增大,但是![]() 和
和![]() 的物质的量浓度之和基本保持不变
的物质的量浓度之和基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温时,a mol/L醋酸与0.1mol/LNaOH溶液等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=___________ (用含a的代数式表示)
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
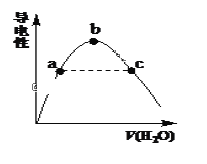
①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-)_____c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是_____(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C 时,向 20 mL 0.10 molL-1的一元酸 HA 中逐滴加入 0.10 molL-1 NaOH 溶液,溶液 pH随加入 NaOH 溶液体积的变化关系如图所示。下列说法正确的是( )

A.HA为强酸
B.a点溶液中,c(A-)>c(Na+)>c(H+)>c(OH-)
C.酸碱指示剂可以选择甲基橙或酚酞
D.b点溶液中,c(Na+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.2mol/LKMnO4酸性溶液0.1L与一定量pH=3的草酸(HOOC—COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molHOOC—COOH含共用电子对数目为0.9NA
B.当1molKMnO4被还原时,强酸提供的H+数目为NA
C.pH=3的草酸溶液含有H+数目为0.001NA
D.该反应释放CO2分子数目为![]() NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如下表,下列有关叙述不正确的是
,在不同的温度下该反应的平衡常数如下表,下列有关叙述不正确的是
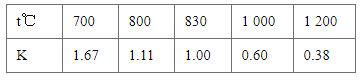
A.该反应的化学方程式是CO(g)+H2O(g)CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol,该反应达到平衡状态
D.若平衡浓度符合关系式![]() =
=![]() ,则此时的温度为1000 ℃
,则此时的温度为1000 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某氨水中加入醋酸溶液,反应方程式如下:NH3·H2O+CH3COOH=CH3COONH4+H2O滴加过程,溶液的导电能力(I)与加入醋酸溶液的体积(V)关系正确的是( )
A.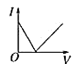 B.
B.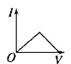 C.
C.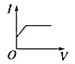 D.
D.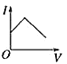
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com