
����Ŀ��![]() ʱ��
ʱ��![]()
![]() ��ˮ�����Ļ�������������
��ˮ�����Ļ�������������![]() ��ַ�Ӧ��������������
��ַ�Ӧ��������������![]() ���ٽ���Ӧ��ʣ�������ȴ����뺬��
���ٽ���Ӧ��ʣ�������ȴ����뺬��![]() ��
��![]() ��
��![]() ��
��![]() �����ӵ�ˮ��Һ�У�����Һ������ֲ��䣬������˵������ȷ����( )
�����ӵ�ˮ��Һ�У�����Һ������ֲ��䣬������˵������ȷ����( )
A.ԭ��������ƽ��Ħ������Ϊ![]()
B.���������![]() ��Ӧ�����е���ת�Ƶ����ʵ���Ϊ
��Ӧ�����е���ת�Ƶ����ʵ���Ϊ![]()
C.��Һ��![]() �����ʵ���Ũ�Ȼ������ֲ���
�����ʵ���Ũ�Ȼ������ֲ���
D.��Һ��![]() �����ʵ���Ũ�ȼ�С��
�����ʵ���Ũ�ȼ�С��![]() �����ʵ���Ũ��������
�����ʵ���Ũ��������![]() ��
��![]() �����ʵ���Ũ��֮�ͻ������ֲ���
�����ʵ���Ũ��֮�ͻ������ֲ���
���𰸡�A
��������
�������Ĺ���![]() ��ͨ��
��ͨ��![]() ��
��![]() ������ֻ����
������ֻ����![]() ������Ϊ����
������Ϊ����![]() �����������غ㶨�ɿ�֪
�����������غ㶨�ɿ�֪![]() ������
������![]() ��
��
A.���ݷ���ʽ![]() ��
�� ![]() ��֪��������
��֪��������![]() ����ˮ��������2mol����1molO2��������0.25molO2����
����ˮ��������2mol����1molO2��������0.25molO2����![]() ��ˮ�����������ʵ�����0.5mol������ԭ��������ƽ��Ħ������Ϊ
��ˮ�����������ʵ�����0.5mol������ԭ��������ƽ��Ħ������Ϊ![]() ����A��ȷ��
����A��ȷ��
B.��Ӧ����������Ϊ![]() ����Ԫ����-1��Ϊ0��ת�Ƶ���Ϊ
����Ԫ����-1��Ϊ0��ת�Ƶ���Ϊ![]() ����B����
����B����
C.����������ʣ�࣬��������![]() ����Һ��
����Һ��![]() �����ʵ���Ũ�ȼ�С����C����
�����ʵ���Ũ�ȼ�С����C����
D.���ڷ�Ӧ������к���̼���ƣ���Һ![]() ��
��![]() �����ʵ���Ũ��֮������D����
�����ʵ���Ũ��֮������D����
��ѡA��


 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����������ó��Ľ��۾���ȷ����
ѡ�� | ʵ����� | ���� | ���� |
A | ��ʢ��Ʒ�����ֻ�Թ��зֱ�ͨ��SO2��Cl2 | Ʒ�����ɫ | ����Ư��ԭ����ͬ |
B | �������ͬ��pH��Ϊ3.3��һԪ��HX��HY�зֱ��������п�� | ������H2ǰ�߱Ⱥ��߶� | HX��HY�������� |
C | ��������FeS��CuS�зֱ����0.3mol/L���� | ǰ���ܽ⣬���߲��� | Ksp(FeS)>Ksp(CuS) |
D | ��ʢ����ͬ�����10%H2O2��Һ����ֻ�Թ��зֱ������������KMnO4��Һ��FeCl3��Һ | ǰ�߲���������� | KMnO4�����Ա�FeCl3�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵĵ���ƽ�⡢�����ˮ��ƽ�����������ܽ�ƽ������ڻ�ѧƽ�⣮����Ҫ��ش�����
(1)����������������ˮ�����侻ˮ��ԭ����___________�������ӷ���ʽ��ʾ����
(2)���ʵ���Ũ����ͬ��CH3COOH ��Һ��NaOH ��Һ��Ϻ���Һ��c��CH3COO��=c��Na+������CH3COOH ��Һ�����_____NaOH ��Һ�������������ڡ�����С�ڡ����ڡ�����
(3)�����£�ȡ0.2molL��1 HCl��Һ��0.2molL��1 MOH��Һ�������ϣ���û����Һ���pH��5��д��MOH�ĵ��뷽��ʽ��_______________________��
(4)��![]() �ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10��3 molL��1��
�ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10��3 molL��1��![]() ��Ϊ��ʹ��ˮ���ŷŴ�꣬�������´�����
��Ϊ��ʹ��ˮ���ŷŴ�꣬�������´�����
![]()
���̷�ΪFeSO47H2O����Ӧ��I����Cr2O72����FeSO4�����ʵ���֮��Ϊ_____��
����������������ķ�ˮ��c��Cr3+����6.0��10��7 molL��1��������ķ�ˮ��pH��_____��Ksp[Cr��OH��3]��6.0��10��31��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪���淴ӦCO(g) + H2O (g)![]() CO2(g) + H2(g)����830K�¶��´ﵽƽ�⡣
CO2(g) + H2(g)����830K�¶��´ﵽƽ�⡣
��830Kʱ������ʼʱ��c (CO) �� 2 mol/L��c (H2O) �� 3 mol/L��ƽ��ʱCO��ת����Ϊ60%����÷�Ӧ��ƽ�ⳣ��K=______________��
��830K����ֻ����ʼʱc (H2O)��Ϊ6 mol/L����ˮ������ת����Ϊ____________��
��2����֪��Ӧ��2CO(g)+O2(g)=2CO2(g) ��H=��566kJ/mol ����CO��ȼ����Ϊ_______��
��3����֪�������������ϳɰ���ӦΪ��N2(g)��3H2(g)![]() 2NH3(g) ��H��-92kJ/mol��ȡ1 mol N2(g)��3 molH2(g)����һ�ܱ������У�һ�������½��з�Ӧ����ƽ��ʱ����÷�Ӧ�ų�������___________92kJ��������������������������С���������������¶ȣ�������Ӧ����H___________�����������������С����������������
2NH3(g) ��H��-92kJ/mol��ȡ1 mol N2(g)��3 molH2(g)����һ�ܱ������У�һ�������½��з�Ӧ����ƽ��ʱ����÷�Ӧ�ų�������___________92kJ��������������������������С���������������¶ȣ�������Ӧ����H___________�����������������С����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.MnO2�ܼ���H2O2�ķֽ⣬����ΪMnO2���Խ��ͷ�Ӧ����Ļ��
B.���ɫ��K2Cr2O7��Һ�еμ�NaOH��Һ����Һ��ɫ��ƣ�˵����ѧƽ�ⷢ�����ƶ�
C.��ʢ��NO2������ܱ�������������ˮ�У�������������ɫ�����һ��ʵ��������������ԭ������
D.FeCl3��Һ��Fe2(SO4)3��Һ�������ɡ����ն��õ�Fe2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��������ͼ��ʾ���װ�ã����ּг�װ��δ����������̽��ʵ�顣
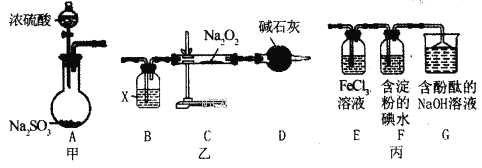
��ش��������⣺
��1��Aͬѧ���ס���װ����Ͻ���ʵ�飬��ʵ��Ŀ����̽��__��Ӧ������������Ӻ�װ�ú�����Ҫ���е�ʵ�����Ϊ___��
��2��Ϊ����Cװ���з�Ӧ�������Ƿ���������װ��B��ʢ�ŵ��Լ�XӦΪ__��װ��D�м�ʯ�ҵ�������__��
��3��Bͬѧ���ס���װ����Ͻ���ʵ�飬��˵��I-�Ļ�ԭ������SO2������Ϊ__��������Ӧ�����ӷ���ʽ��__��
��4��װ��G�е�������__��˵��SO2����__�ԡ�
��5��Ϊ��֤װ��E��SO2��FeCl3������������ԭ��Ӧ��Cͬѧ�����������������±���
ʵ����� | ʵ������ | ʵ����� | |
����1 | ȡ����װ��E�е���Һ���Թ��У������еμ�___��Һ | ������ɫ���� | SO2��FeCl3������������ԭ��Ӧ |
����2 | ȡ����װ��E�е���Һ���Թ��У������еμ�___��Һ | ___ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��������ͼװ���о��绯ѧԭ��������˵��������ǣ�������
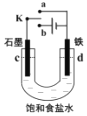
A.K ��a ���ӣ������缫�������ʴ�������ĵ缫��ӦΪFe-2e-��Fe2+
B.K ��a ���ӣ����װ���ܽ���ѧ��ת��Ϊ����
C.K �� b ���ӣ����װ�����缫�ĵ缫��Ӧ 2H++2e-��H2��
D.K ��b ���ӣ������缫���������÷�������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ���ǣ� ��
A.��״���£�22.4L���ȼ���ķ�����ԼΪNA
B.��ϩ�ͱ�ϩ��ɵ�42g��������к�̼ԭ����Ϊ6NA
C.1mol�״���ȫȼ������CO2��H2O��ת�Ƶĵ�����ĿΪ12NA
D.��1molCH3COONa����ϡ��������Һ�����ԣ���Һ��CH3COO-��Ŀ����NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��10mL0.1mol��L��1Na2CO3��Һ����μ���0.1mol��L��1HCl��Һ20mL����Һ�в��ֺ�̼�������ʵ�������ҺpH�ı仯��ͼ��ʾ������˵������ȷ���ǣ� ��

A.A��ʱ��c��Na+����c��CO32����=c��HCO3������c��OH������c��H+��
B.����Һ��pH��8ʱ����Һ��NaHCO3�����ʵ���Ũ��Ϊ0.1moL��L��1
C.a��b���߷ֱ��������HCO3����H2CO3���ı仯���
D.Na2CO3��Һ��c��Na+��=2��c��CO32����+c��HCO3����+c��H2CO3����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com