
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
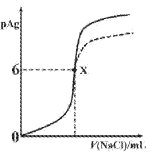
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
【答案】B
【解析】
A.图中原点pAg=0,则Ag+的浓度为:c(Ag+)=1mol/L,即原AgNO3溶液的物质的量浓度为1mol·L-1,故A错误;
B.x点c(Ag+)=1![]() mol·L-1,一般认为溶液中离子浓度小于
mol·L-1,一般认为溶液中离子浓度小于![]() mol·L-1完全沉淀,故B正确;
mol·L-1完全沉淀,故B正确;
C.x点c(Ag+)=1![]() mol·L-1,,一般认为溶液中离子浓度小于
mol·L-1,,一般认为溶液中离子浓度小于![]() mol·L-1,即沉淀完全,则AgNO3与NaCl恰好反应,由A求得原AgNO3溶液的物质的量浓度为1mol·L-1,则有:n(NaCl)=n(AgNO3)=0.01L
mol·L-1,即沉淀完全,则AgNO3与NaCl恰好反应,由A求得原AgNO3溶液的物质的量浓度为1mol·L-1,则有:n(NaCl)=n(AgNO3)=0.01L![]() 1mol/L=0.01mol,所以v(NaCl)=100ml,即x点的坐标为(100,6),故C错误;
1mol/L=0.01mol,所以v(NaCl)=100ml,即x点的坐标为(100,6),故C错误;
D.与AgCl相比,碘化银的Ksp(AgI)更小,所以把NaCl换成0.1mo1·L-1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误;
本题答案为B。


科目:高中化学 来源: 题型:
【题目】有机物I是一种常用的植物调味油,常用脂肪烃A和芳香烃D按如下路线合成:

已知①RCHO+CH3CHO![]() RCH=CHO+H2O
RCH=CHO+H2O
②通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1) A的名称是_______,H含有的官能团名称是________。
(2)②的反应条件是_______________,⑦的反应类型是_______________。
(3) I的结构简式是____________________。
(4)④的化学方程式是_______________________________。
(5)L是I的同分异构体且含有相同的官能团,其结构中苯环上只有两个处于对位的取代基,则L共有_____种 (不考虑立体异构)。
(6)参照上述合成路线,设计以C为原料制备保水树脂![]() ,的合成路线(无机试剂任选)__________________
,的合成路线(无机试剂任选)__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,反应①为 2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) ![]() 反应②生成1molCl2(g)的反应热为
反应②生成1molCl2(g)的反应热为![]() ,则总反应的热化学方程式为_______________(反应热△H用含
,则总反应的热化学方程式为_______________(反应热△H用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
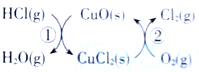
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①该反应的![]() ____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
②100℃时达平衡后,改变反应温度为![]() ,c(N2O4)以0.0020 mol·L
,c(N2O4)以0.0020 mol·L![]() ·s
·s![]() 的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
③计算温度T时反应的平衡常数K___________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向___________(填“正反应”或“逆反应”)方向移动,N2O4的转化率______(填“增大”或“减小”)。
时间(s) | 0 | 20 | 40 | 60 | 80 |
N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
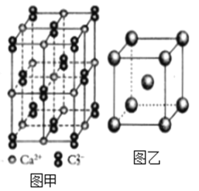
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
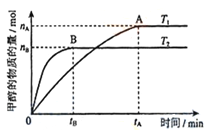
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述错误的是( )
A.2 g D![]() O中含有的质子数、中子数、电子数均为NA
O中含有的质子数、中子数、电子数均为NA
B.含有NA个“Cu”微粒的CuO和Cu2S混合物质量为80 g
C.标准状况下,5.6 L氧气作氧化剂时转移电子数一定为NA
D.58.5 g NaCl晶体中含有NA个Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2mol·L-1 的NaOH溶液500mL和0.5mol·L-1的硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___(填序号),配制上述溶液还需用到的玻璃仪器是____(填仪器名称)。

(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的___(填写序号)。
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是___(用字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算好的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)根据计算,配制0.2mol·L-1的 NaOH溶液500mL需NaOH固体的质量为__g。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是___。
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol·L-1。请你分析下列哪些操作会引起所配浓度偏小_____(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是( )
A.![]() 是酸性氧化物,不溶于水,也不能与任何酸发生反应
是酸性氧化物,不溶于水,也不能与任何酸发生反应
B.![]() 、
、![]() 组成元素虽然相同,但与
组成元素虽然相同,但与![]() 、
、![]() 等反应的产物不完全相同
等反应的产物不完全相同
C.CO、![]() 、NO、
、NO、![]() 都是对大气产生污染的气体,他们在空气中都能稳定存在
都是对大气产生污染的气体,他们在空气中都能稳定存在
D.浓硫酸可用于干燥氢气、氯化氢、碘化氢等气体,但不能干燥氨气、二氧化氮气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
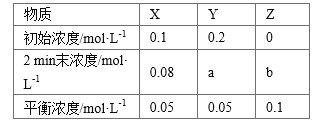
下列说法正确的是
A. 平衡时,X的转化率为20%
B. t ℃时,该反应的平衡常数为40
C. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D. 前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com