
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
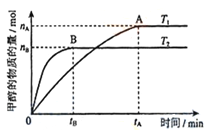
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
【答案】(1)![]() ;
;
(2)-99;<
(3)③④
(4)3:4;6.75或27/4
【解析】
试题分析:(1)CO2的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)①CO(g)+2H2(g) ![]() CH3OH(g) △H1,②CO2(g)+3H2(g)
CH3OH(g) △H1,②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol,③CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H2=-58 kJ/mol,③CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H3=+41 kJ/mol,根据盖斯定律:反应②-反应③=反应①,故△H1=△H2-△H3=-99 kJ/mol,反应①中气体的物质的量减少,属于熵减小的反应,故答案为:-99;<;
CO(g)+H2O(g) △H3=+41 kJ/mol,根据盖斯定律:反应②-反应③=反应①,故△H1=△H2-△H3=-99 kJ/mol,反应①中气体的物质的量减少,属于熵减小的反应,故答案为:-99;<;
(3)①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=![]() =nA/2tA mol/(L·min),错误;②根据CO2+3H2
=nA/2tA mol/(L·min),错误;②根据CO2+3H2![]() CH3OH+H2O,如何时刻都存在v(CH3OH) = v(H2O)时,不能说明反应达到平衡,错误;③该反应属于气体的物质的量减少的反应,甲醇的物质的量越多,混合气体的物质的量越少,混合气体的平均相对分子质量越大,混合气体的平均相对分子质量A点大于B点,正确;④处于A点的反应体系从T1变到T2,平衡向逆反应方向移动,达到平衡时n(H2)与n(CH3OH)比值增大,正确;故选③④;
CH3OH+H2O,如何时刻都存在v(CH3OH) = v(H2O)时,不能说明反应达到平衡,错误;③该反应属于气体的物质的量减少的反应,甲醇的物质的量越多,混合气体的物质的量越少,混合气体的平均相对分子质量越大,混合气体的平均相对分子质量A点大于B点,正确;④处于A点的反应体系从T1变到T2,平衡向逆反应方向移动,达到平衡时n(H2)与n(CH3OH)比值增大,正确;故选③④;
(4)温度T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度,可逆反应CO2+3H2![]() CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CO2转化率为50%,转化的二氧化碳为1mol,则:
CO2 (g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始(mol):2 6 0 0
变化(mol):1 3 1 1
平衡(mol):1 3 1 1
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=![]() =
=![]() ,平衡常数=
,平衡常数=![]() =
=![]() =
=![]() ,CH3OH(g)+H2O(g)
,CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数与CO2+3H2
CO2(g)+3H2(g)的平衡常数与CO2+3H2![]() CH3OH+H2O的平衡常数互为倒数,因此CH3OH(g)+H2O(g)
CH3OH+H2O的平衡常数互为倒数,因此CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数=
CO2(g)+3H2(g)的平衡常数=![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。

⑴写出装置A中发生反应的化学方程式: 。
⑵写出试剂Y的名称:__________________。
⑶已知:通入一定量的氯气后,测得D中只有一种常温下为黄棕色的气体,其为含氯氧化物。可以确定的是C中含氯化合物(盐)只有一种,且含有NaHCO3,现对C的成分进行猜想和探究。
提出合理假设。
假设1:存在两种成分:NaHCO3和_____________;
假设2:存在三种成分:NaHCO3、_____________和_____________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于a、b试管中 | — |
步骤2: | |
步骤3: |
⑷已知C中有0.1 mol Cl2参加反应。若假设1成立,可推知C中反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(2)反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61
生产中应选用水碳比的数值为 (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO22HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为 %。
(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,
则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO的标准燃烧热是△H=-283.0KJ/mol,
则反应CO(g)+![]() O2(g)═CO2(g)的△H=﹣283.0KJ/mol
O2(g)═CO2(g)的△H=﹣283.0KJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫黄的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目减少的是( )
A.Na+ B.Fe3+
C.Al3+ D.Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Na2CO3、NaHCO3的性质。回答下列问题:
(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是______________。
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示:
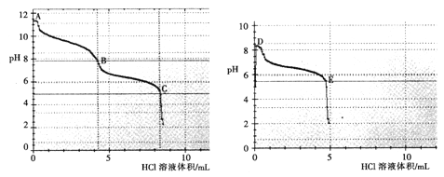
碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是__________(填A、B、C、D或E)。
B点的主要溶质是_____________(用化学式表示)。
③ B点__________(填“大于”或“小于”) D点的pH,主要原因是________________。
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关右图装置的叙述中,正确的是( )
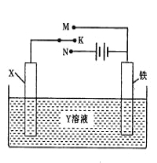
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为外接电源的阴极保护法
B.若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变
C.若X为银棒,Y为硝酸银溶液,开关K置于N处,铁棒质量将增加,溶液中银离子浓度将减小
D.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铁电极移动[来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应中的能量变化,表述正确的是( )
A.放热反应中,反应物的总能量大于生成物的总能量
B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应
D.氧化反应均为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按原子序数递增,下列有关碱金属元素性质的递变规律正确的是( )
A. 失电子能力逐渐增强
B. 化合价逐渐升高
C. 金属性逐渐减弱
D. 最高价氧化物对应的水化物碱性逐渐减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com