
【题目】某班同学用如下实验探究Na2CO3、NaHCO3的性质。回答下列问题:
(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是______________。
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示:
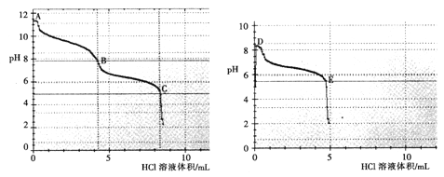
碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是__________(填A、B、C、D或E)。
B点的主要溶质是_____________(用化学式表示)。
③ B点__________(填“大于”或“小于”) D点的pH,主要原因是________________。
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式:_________________________。
【答案】(1)碳酸钠与水反应生成Na2CO3·xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量。
(2)①BC;②NaCl和NaHCO3;③小于,B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点。
(3)2NaHCO3+Mg=MgCO3↓+ Na2CO3+H2↑
【解析】
试题分析:(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是碳酸钠与水反应生成Na2CO3·xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量;(2)① 碳酸钠与盐酸反应分2步,![]() 、
、![]() ,pH有两次突变,达到两次反应终点,分别是BC;②B点恰好完成
,pH有两次突变,达到两次反应终点,分别是BC;②B点恰好完成![]() 反应,所以B点的主要溶质是NaCl和NaHCO3;③ B点小于D点的pH,主要原因是B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点;(3)NaHCO3溶液加入镁粉,发现有气泡和沉淀生成,化学方程式:2NaHCO3+Mg=MgCO3↓+ Na2CO3+H2↑。
反应,所以B点的主要溶质是NaCl和NaHCO3;③ B点小于D点的pH,主要原因是B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点;(3)NaHCO3溶液加入镁粉,发现有气泡和沉淀生成,化学方程式:2NaHCO3+Mg=MgCO3↓+ Na2CO3+H2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,若使pH=3的盐酸与pH=9的Ba(OH)2溶液混合使其成为pH=7的溶液,混合时盐酸和Ba(OH)2溶液的体积比为
A.1∶60 B.3∶1
C.1∶100 D.100∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理生活污水中的NH4+,过程如下:

(1)空气将NH4+转变为NO3-或NO2-,溶液pH__________(填“增大”、“减小”或 “不变”)。
(2)根据较新的研究表明,将只含NO2-的污水与含NH4+的污水按比例混合,直接转化为无毒气体,该气体为_________。此方法的优点是__________。
(3)完全处理含1mol NH4+污水,则n(O2)与n(CH3OH)关系式为___________[以n(O2)与n(CH3OH)表示]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
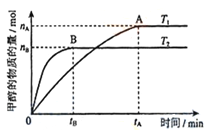
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO和CO都是汽车排放尾气中的有害物质,它们能缓慢地反应,生成N2和CO2。对此反应下列叙述正确的
A.催化剂能使不发生反应的物质发生反应
B.使用催化剂可以加快反应速率
C.降低压强能加快反应速率
D.降温可以加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12g铁粉加入25mL 2molL﹣1的氯化铁溶液中,充分反应后,其结果是( )
A. 铁有剩余,溶液呈浅绿色,Cl﹣浓度基本不变
B. 往溶液中滴入无色KSCN溶液,显黄色
C. Fe2+和Fe3+的物质的量之比为6:1
D. 氧化产物与还原产物的物质的量之比为2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是( )
A.减小压强能增大反应速率
B.增大压强能减小反应速率
C.使用适当的催化剂能增大反应速率
D.升高温度对反应速率无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 4 molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3 molL-1s-1
②物质 B的体积分数是40%
③2 s 时物质 A 的转化率为30%
④2 s 时物质 B 的浓度为 1.0 molL-1
其中正确的是
A. ①④ B. ②③ C. ①③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com