
【题目】将 4 molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3 molL-1s-1
②物质 B的体积分数是40%
③2 s 时物质 A 的转化率为30%
④2 s 时物质 B 的浓度为 1.0 molL-1
其中正确的是
A. ①④ B. ②③ C. ①③ D. ③④
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Na2CO3、NaHCO3的性质。回答下列问题:
(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是______________。
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示:
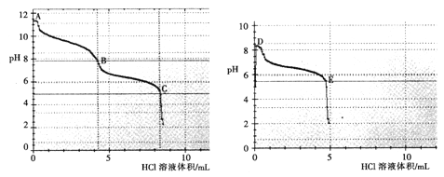
碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是__________(填A、B、C、D或E)。
B点的主要溶质是_____________(用化学式表示)。
③ B点__________(填“大于”或“小于”) D点的pH,主要原因是________________。
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述正确的是 ( )


A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源负极相连
C.装置③中外电路电子由a极流向b极
D.装置④的阳极反应为:2H+ + 2e— = H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳和二氧化硫是用途广泛的化工基础原料。
(1)已知:C(s)+O2(g)=CO2(g) △H1=– 393.5 kJ·mol – 1
C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol – 1
S(s)+O2(g)=SO2(g) △H3=– 296.0 kJ·mol – 1
已知某反应的平衡常数![]() ,据以上信息,请写出该反应的热化学反应方程式: 。
,据以上信息,请写出该反应的热化学反应方程式: 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
(3)工业利用反应2SO2(g)+O2(g) ![]() 2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体密度保持不变
c.SO2和O2的物质的量之比保持不变
d.每消耗1 mol SO3的同时,生成0.5 mol O2
(4)下图中A装置为熔融盐燃料电池的工作原理示意图。某课外活动小组用下图所示装置通过电解生成Fe(OH)3进行水的净化。

①已知该燃料电池负极的电极反应是CH4+4CO32--8e- = 5CO2+2H2O。
则正极的电极反应式是 。
电解池B阳极的电极反应式为 。
②实验过程中,若在阴极产生了22.4 L(标准状况)气体,则熔融盐燃料电池消耗CH4 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按原子序数递增,下列有关碱金属元素性质的递变规律正确的是( )
A. 失电子能力逐渐增强
B. 化合价逐渐升高
C. 金属性逐渐减弱
D. 最高价氧化物对应的水化物碱性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下可逆反应:2NO2(g)![]() 2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基本化工原料,以它为原料还可以合成很多的化工产品。现有以下转化:

(1)聚乙烯的结构简式为 ;
(2)写出以下反应的化学方程式和反应类型:
② ,反应类型是
③ ,反应类型是
(3)实验室用如图装置制备乙酸乙酯:试管中碎瓷片的作用是 ;导管a的作用是导气和 ;试管b内饱和Na2CO3溶液的作用一方面是除去乙酸乙酯中混有的乙酸和乙醇,另一方面是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳原子数目相同的油和脂肪是同分异构体
B.碳原子数目相同的油和脂肪是同一种物质
C.碳原子数目不相同的油和脂肪是同系物
D.油和脂肪都属于酯类物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,列出了10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
第2周期 | ⑥ | ⑦ | ||||||
第3周期 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
第4周期 | ② | ④ |
(1)10
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是 ,(填化学式)该物质内部含有的化学键类型是 和 ;
(3)元素⑦的氢化物的化学式为 ;该氢化物常温下和元素②的单质反应的化学方程式 ;
(4)③和⑨两元素形成化合物的电子式是 ;①和⑦两元素形成四核化合物的电子式是 ,该物质与CO2反应的化学方程式为 。
(5)①和⑤最高价氧化物对应水化物相互反应的离子方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com