
【题目】存在大量H+、Br-和Ca2+的溶液中还能大量存在( )
A.OH- B.Ag+ C.CO32- D.NO3-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 不慎打翻燃着的酒精灯,应立即用湿抹布盖灭
B. 金属镁着火时应立即用泡沫灭火器灭火
C. 不小心将浓碱液滴到皮肤上,应立即用大量水冲洗,然后涂点稀硼酸溶液
D. 蒸馏实验时如果蒸馏烧瓶中忘加沸石,应立即停止加热,冷却后补加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠作为一种重要原料,可用于制造许多在国防工业上有重要用途的金属。下列关于钠的说法不正确的是( )
A. 银白色固体 B. 密度比水大 C. 能与水剧烈反应 D. 可保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A.4g固体硫完全燃烧生成SO2,放出37 kJ热量:S(s)+O2(g)=SO2(g) ΔH= -296kJ/mol
B.1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:
N2(g)+3H2(g)![]() 2NH3(g) △H= -73kJ/mol
2NH3(g) △H= -73kJ/mol
C.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g) ==CO2(g)+ 2H2O(g) ΔH=-890.3kJ·mol-1
D.强酸强碱的中和热为- 57.3 kJ/mol:
Ba(OH) 2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l) ΔH=-114.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,
则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO的标准燃烧热是△H=-283.0KJ/mol,
则反应CO(g)+![]() O2(g)═CO2(g)的△H=﹣283.0KJ/mol
O2(g)═CO2(g)的△H=﹣283.0KJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫黄的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )
选项 | X | Y |
A | SO2 | H2S |
B | Cl2 | CO2 |
C | NH3 | CO2 |
D | SO2 | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Na2CO3、NaHCO3的性质。回答下列问题:
(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是______________。
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示:
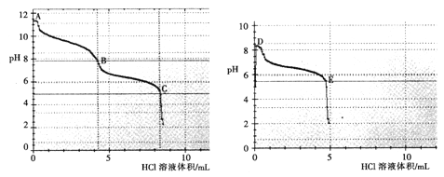
碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是__________(填A、B、C、D或E)。
B点的主要溶质是_____________(用化学式表示)。
③ B点__________(填“大于”或“小于”) D点的pH,主要原因是________________。
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.向密闭容器中通入0.1molN2和0.3molH2,在一定条件下充分反应,容器中N原子数为0.2NA
B.Cu-Zn-CuSO4原电池工作时,当转移电子数为0.2NA时,正极溶解Zn6.5g
C.电解102g熔融的Al2O3,能产生54g金属铝和33.6LO2,转移电子数为6NA
D.电解精炼铜当转移电子数为2NA时,阳极溶解的铜和阴极析出的铜均为64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳和二氧化硫是用途广泛的化工基础原料。
(1)已知:C(s)+O2(g)=CO2(g) △H1=– 393.5 kJ·mol – 1
C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol – 1
S(s)+O2(g)=SO2(g) △H3=– 296.0 kJ·mol – 1
已知某反应的平衡常数![]() ,据以上信息,请写出该反应的热化学反应方程式: 。
,据以上信息,请写出该反应的热化学反应方程式: 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
(3)工业利用反应2SO2(g)+O2(g) ![]() 2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体密度保持不变
c.SO2和O2的物质的量之比保持不变
d.每消耗1 mol SO3的同时,生成0.5 mol O2
(4)下图中A装置为熔融盐燃料电池的工作原理示意图。某课外活动小组用下图所示装置通过电解生成Fe(OH)3进行水的净化。

①已知该燃料电池负极的电极反应是CH4+4CO32--8e- = 5CO2+2H2O。
则正极的电极反应式是 。
电解池B阳极的电极反应式为 。
②实验过程中,若在阴极产生了22.4 L(标准状况)气体,则熔融盐燃料电池消耗CH4 L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com